Asia Pacific Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Tamanho do mercado em biliões de dólares
CAGR :
% 
 USD
130.00 Million
USD
403.24 Million
2025
2033
USD
130.00 Million
USD
403.24 Million
2025
2033
| 2026 –2033 | |
| USD 130.00 Million | |
| USD 403.24 Million | |
|
|
|
|
Avaliação Eletrónica de Resultados Clínicos (eCOA) da Ásia-Pacífico para o Mercado de Conteúdos Licenciados, Por Produto (Soluções On-Premise, Soluções Baseadas na Nuvem, Soluções Baseadas na Web), Abordagem (Avaliação de Resultados Relatados pelo Médico (ClinRO), Avaliação dos Resultados Reportados pelo Doente (PRO) , Avaliação dos resultados reportados pelo observador (ObsRO), Avaliação dos resultados de desempenho (PerfO)), Utilizador final (prestadores de serviços comerciais, hospitais e centros de transplantação, laboratórios de investigação, instituições académicas ), Plataforma (organizações de investigação por contrato, empresas farmacêuticas e biofarmacêuticas, fabricantes de dispositivos médicos , Hospitais e laboratórios clínicos, empresas de serviços de consultoria, investigação e academia, outros), país (China, Coreia do Sul, Japão, Índia, Austrália , Singapura, Malásia, Indonésia, Tailândia, Filipinas e resto da Ásia-Pacífico) Tendências e previsões da indústria até 2028
 Análise e Insights de Mercado: Avaliação Eletrónica de Resultados Clínicos (eCOA) da Ásia-Pacífico para o Mercado de Conteúdos Licenciados
Análise e Insights de Mercado: Avaliação Eletrónica de Resultados Clínicos (eCOA) da Ásia-Pacífico para o Mercado de Conteúdos Licenciados
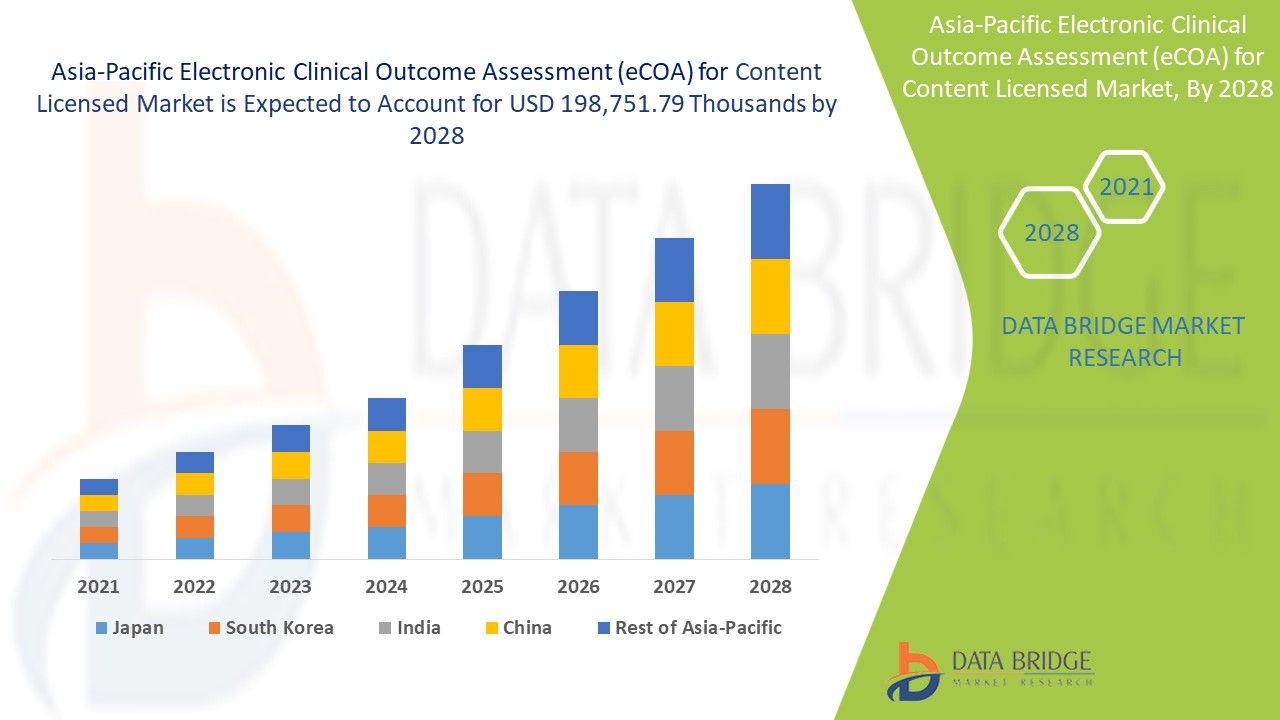
Espera-se que o mercado de avaliação eletrónica de resultados clínicos (eCOA) para licenciamento de conteúdos ganhe crescimento de mercado no período previsto de 2021 a 2028. A Data Bridge Market Research analisa que o mercado está a crescer com o maior CAGR de 15,2 % no período previsto de 2021. até 2028 e prevê-se que atinja os 198.751,79 mil dólares até 2028. O aumento das avaliações eletrónicas de resultados clínicos (eCOAs) na era da centralidade no doente, que está a acelerar o mercado de avaliação eletrónica de resultados clínicos (eCOA) para conteúdo licenciado.
A avaliação eletrónica de resultados clínicos (eCOA) é o método de captura eletrónica de dados em ensaios clínicos . Pode aumentar substancialmente a qualidade dos dados do estudo e, ao mesmo tempo, cumprir os requisitos regulamentares. O eCOA emprega tecnologias como dispositivos portáteis, tablets ou a web para permitir que os participantes de ensaios clínicos, médicos e prestadores de cuidados relatem diretamente informações relacionadas com os resultados dos cuidados de saúde.
A crescente procura de eCOA devido à sua capacidade de recolher grandes quantidades de dados e, ao mesmo tempo, garantir uma elevada qualidade está a acelerar a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados. Os elevados custos financeiros iniciais associados à implementação e utilização destes sistemas podem restringir a avaliação eletrónica dos resultados clínicos (eCOA) para o mercado de conteúdos licenciados. Os níveis crescentes de inovações e avanços tecnológicos (IA, ML, testes de precisão, intervenção guiada pela precisão, IoMT) estão a criar oportunidades para a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados. A falta de profissionais bem formados para a interpretação precisa de dados é um grande desafio para o mercado de avaliação eletrónica de resultados clínicos (eCOA) para conteúdos licenciados.
Este relatório de avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados fornece detalhes sobre a quota de mercado, novos desenvolvimentos e análise de pipeline de produtos, impacto dos participantes do mercado nacional e localizado, analisa as oportunidades em termos de bolsas de receitas emergentes, alterações nas regulamentações de mercado, aprovações de produtos, decisões estratégicas, lançamentos de produtos, expansões geográficas e inovações tecnológicas no mercado. Para compreender a análise e o cenário de mercado, contacte-nos para um Briefing de Analista.
 Avaliação Eletrónica de Resultados Clínicos (eCOA) para Conteúdo Licenciado Âmbito do Mercado e Tamanho do Mercado
Avaliação Eletrónica de Resultados Clínicos (eCOA) para Conteúdo Licenciado Âmbito do Mercado e Tamanho do Mercado
O mercado de avaliação eletrónica de resultados clínicos (eCOA) para conteúdos licenciados é segmentado com base no produto, abordagem, utilizador final e plataforma. O crescimento entre segmentos ajuda-o a analisar os nichos de crescimento e as estratégias para abordar o mercado e determinar as suas principais áreas de aplicação e a diferença nos seus mercados-alvo.
- Com base no produto, a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados é segmentada em soluções locais, soluções baseadas na cloud e soluções baseadas na web. Em 2021, o segmento local detém a maior quota de mercado na avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados, uma vez que o local é a licença perpétua com um conjunto fixo de estudos disponíveis para os clientes.
- Com base na abordagem, a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados é segmentada em avaliação de resultados reportados pelo clínico (ClinRO), avaliação de resultados reportados pelo doente (PRO), avaliação de resultados reportados pelo observador ( ObsRO) e avaliação dos resultados de desempenho (PerfO). Em 2021, o segmento de avaliação de resultados reportados pelo clínico (ClinRO) detém a maior quota de mercado na avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados, uma vez que a medida ClinRO envolve um julgamento clínico ou interpretação dos sinais observáveis. , comportamentos ou outras manifestações físicas consideradas relacionadas com uma doença ou condição.
- Com base no utilizador final, a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados está segmentada em prestadores de serviços comerciais, hospitais e centros de transplantação, laboratórios de investigação e instituições académicas. Em 2021, o segmento de laboratórios de investigação e instituições académicas detém a maior quota de mercado na avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados, uma vez que a organização de investigação e instituição académica utilizada amplamente nas indústrias de desenvolvimento clínico e de medicamentos refere-se principalmente a uma instituição académica e/ou instituição sem fins lucrativos que desempenha uma ou mais funções na condução de ensaios clínicos.
- Com base na plataforma, a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados está segmentada em organizações de investigação por contrato , empresas farmacêuticas e biofarmacêuticas, fabricantes de dispositivos médicos , empresas de serviços de consultoria, hospitais e laboratórios clínicos, investigação e ginásio, entre outros. Em 2021, o segmento das organizações de investigação contratadas detém a maior quota de mercado na avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados, uma vez que uma organização de investigação contratada (CROs) é uma organização de serviços que presta apoio às indústrias farmacêutica e biotecnológica sob a forma de outsourcing.
Avaliação Eletrónica de Resultados Clínicos (eCOA) para Análise de Nível de País de Mercado de Conteúdo Licenciado
A avaliação eletrónica dos resultados clínicos (eCOA) para o mercado de conteúdos licenciados é analisada e são fornecidas informações sobre o tamanho do mercado por país, produto, abordagem, utilizador final e plataforma.
Os países abrangidos pela avaliação eletrónica de resultados clínicos (eCOA) para o relatório de mercado de conteúdos licenciados são o Japão, China, Índia, Coreia do Sul, Austrália, Singapura, Malásia, Tailândia, Indonésia, Filipinas e restante Ásia-Pacífico.
Na região Ásia-Pacífico, a China está a dominar devido ao aumento das avaliações eletrónicas de resultados clínicos (eCOAs) na era da centralidade no doente.
A secção do relatório sobre os países também fornece fatores individuais que impactam o mercado e alterações na regulamentação do mercado nacional que impactam as tendências atuais e futuras do mercado. Pontos de dados como novas vendas, vendas de reposição, demografia do país, atos regulamentares e tarifas de importação e exportação são alguns dos principais indicadores utilizados para prever o cenário de mercado para países individuais. Além disso, a presença e a disponibilidade de marcas da Ásia-Pacífico e os desafios enfrentados devido à grande ou escassa concorrência de marcas locais e nacionais, bem como o impacto dos canais de vendas, são considerados ao fornecer uma análise de previsão dos dados do país.
Número crescente de ensaios clínicos
A avaliação eletrónica dos resultados clínicos (eCOA) para o mercado de conteúdos licenciados também fornece uma análise detalhada do mercado para o crescimento da indústria em cada país com vendas, vendas de componentes, impacto do desenvolvimento tecnológico na avaliação eletrónica dos resultados clínicos (eCOA) para conteúdos licenciados e alterações na regulamentação cenários com o seu suporte para a avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados. Os dados estão disponíveis para o período histórico de 2010 a 2019.
Cenário competitivo e avaliação eletrónica de resultados clínicos (eCOA) para análise da quota de mercado de conteúdos licenciados
A avaliação eletrónica dos resultados clínicos (eCOA) para o panorama competitivo do mercado de conteúdos licenciados fornece detalhes por concorrente. Os detalhes incluídos são a visão geral da empresa, finanças da empresa, receitas geradas, potencial de mercado, investimento em investigação e desenvolvimento, novas iniciativas de mercado, presença na América do Norte, localizações e instalações de produção , pontos fortes e fracos da empresa, lançamento de produto, pipelines de testes de produto, aprovações de produto, patentes , largura e amplitude do produto, domínio da aplicação, curva de vida da tecnologia. Os pontos de dados fornecidos acima estão apenas relacionados com o foco das empresas relacionadas com a avaliação eletrónica de resultados clínicos (eCOA) da Ásia-Pacífico para o mercado de conteúdos licenciados.
Os principais participantes abrangidos pelo relatório são a Oracle, IBM Corporation, Dassault Systemes, Parexel International Corporation, ERT Clinical, eClinical Solutions LLC, ArisGlobal, Kayentis, Anju Software, Inc., Signant Health, WIRB-Copernicus Group e Bioclinica, entre outros locais e Jogadores da Ásia-Pacífico. Os analistas do DBMR compreendem os pontos fortes competitivos e fornecem análises competitivas para cada concorrente em separado.
Muitos desenvolvimentos de produtos são também iniciados por empresas de todo o mundo, o que está também a acelerar o crescimento da avaliação eletrónica de resultados clínicos (eCOA) para o mercado de conteúdos licenciados.
Por exemplo,
- Em fevereiro de 2021, a ERT Clinical, empresa líder global em dados e tecnologia para recolha de dados de endpoints clínicos, lançou uma nova e poderosa solução, a eCOA Multimedia, para permitir a recolha, o processamento e a análise de fotos e áudio como parte das avaliações eCOA de ensaios clínicos. Com este novo lançamento, a empresa alargou a sua linha de produtos.
As parcerias, joint ventures e outras estratégias aumentam a quota de mercado da empresa com maior cobertura e presença. Também oferece o benefício para as organizações melhorarem a sua oferta de avaliação eletrónica de resultados clínicos (eCOA) para conteúdos licenciados através de uma gama alargada de tamanhos.
SKU-
Obtenha acesso online ao relatório sobre a primeira nuvem de inteligência de mercado do mundo
- Painel interativo de análise de dados
- Painel de análise da empresa para oportunidades de elevado potencial de crescimento
- Acesso de analista de pesquisa para personalização e customização. consultas
- Análise da concorrência com painel interativo
- Últimas notícias, atualizações e atualizações Análise de tendências
- Aproveite o poder da análise de benchmark para um rastreio abrangente da concorrência
Metodologia de Investigação
A recolha de dados e a análise do ano base são feitas através de módulos de recolha de dados com amostras grandes. A etapa inclui a obtenção de informações de mercado ou dados relacionados através de diversas fontes e estratégias. Inclui examinar e planear antecipadamente todos os dados adquiridos no passado. Da mesma forma, envolve o exame de inconsistências de informação observadas em diferentes fontes de informação. Os dados de mercado são analisados e estimados utilizando modelos estatísticos e coerentes de mercado. Além disso, a análise da quota de mercado e a análise das principais tendências são os principais fatores de sucesso no relatório de mercado. Para saber mais, solicite uma chamada de analista ou abra a sua consulta.
A principal metodologia de investigação utilizada pela equipa de investigação do DBMR é a triangulação de dados que envolve a mineração de dados, a análise do impacto das variáveis de dados no mercado e a validação primária (especialista do setor). Os modelos de dados incluem grelha de posicionamento de fornecedores, análise da linha de tempo do mercado, visão geral e guia de mercado, grelha de posicionamento da empresa, análise de patentes, análise de preços, análise da quota de mercado da empresa, normas de medição, análise global versus regional e de participação dos fornecedores. Para saber mais sobre a metodologia de investigação, faça uma consulta para falar com os nossos especialistas do setor.
Personalização disponível
A Data Bridge Market Research é líder em investigação formativa avançada. Orgulhamo-nos de servir os nossos clientes novos e existentes com dados e análises que correspondem e atendem aos seus objetivos. O relatório pode ser personalizado para incluir análise de tendências de preços de marcas-alvo, compreensão do mercado para países adicionais (solicite a lista de países), dados de resultados de ensaios clínicos, revisão de literatura, mercado remodelado e análise de base de produtos . A análise de mercado dos concorrentes-alvo pode ser analisada desde análises baseadas em tecnologia até estratégias de carteira de mercado. Podemos adicionar quantos concorrentes necessitar de dados no formato e estilo de dados que procura. A nossa equipa de analistas também pode fornecer dados em tabelas dinâmicas de ficheiros Excel em bruto (livro de factos) ou pode ajudá-lo a criar apresentações a partir dos conjuntos de dados disponíveis no relatório.