欧州コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の規模、シェア、トレンド分析レポート
Market Size in USD Billion
CAGR :
% 
 USD
704.70 Million
USD
2,067.34 Million
2025
2033
USD
704.70 Million
USD
2,067.34 Million
2025
2033
| 2026 –2033 | |
| USD 704.70 Million | |
| USD 2,067.34 Million | |
|
|
|
|
欧州コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)のセグメンテーション、製品別(オンプレミスソリューション、クラウドベースソリューション、ウェブベースソリューション)、アプローチ別(臨床医報告アウトカム評価(ClinRO)、患者報告アウトカム評価(PRO)、観察者報告アウトカム評価(ObsRO)、パフォーマンスアウトカム評価(PerfO))、エンドユーザー別(商業サービスプロバイダー、病院および移植センター、研究機関、学術機関)、プラットフォーム別(開発業務委託機関、製薬会社およびバイオ医薬品会社、医療機器メーカー、病院および臨床検査機関、コンサルティングサービス会社、研究機関および学術機関、その他) - 2033年までの業界動向と予測
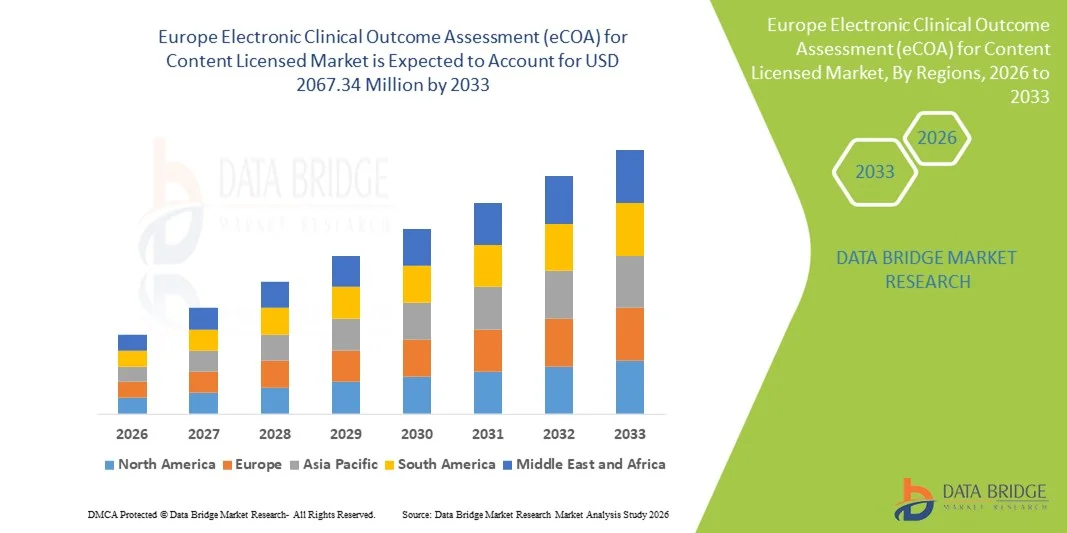
欧州コンテンツライセンス市場規模における電子臨床アウトカム評価(eCOA)
- 欧州のコンテンツライセンス市場規模は、2025年に7億470万米ドルと評価され、 2033年までに2億6734万米ドルに 達すると予想され 、予測期間中に14.40%のCAGR で成長すると予想されています。
- 市場の成長は、臨床試験におけるデジタル技術の導入拡大、患者中心の研究への重点化、そして治療領域全体にわたる正確かつリアルタイムなデータ収集の必要性によって大きく牽引されています。クラウドベースのプラットフォーム、モバイルアプリケーション、電子患者報告アウトカム(ePRO)の統合は、コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の拡大をさらに促進しています。
- さらに、規制に準拠し、ユーザーフレンドリーで拡張性の高い臨床試験ソリューションへの需要の高まりにより、eCOAシステムは現代の臨床研究における重要な要素として確立されつつあります。効率性の向上、管理負担の軽減、そして患者エンゲージメントの向上により、コンテンツライセンスソリューションにおける電子臨床アウトカム評価(eCOA)の普及が加速し、市場の成長を大幅に促進しています。
コンテンツライセンス市場分析のための欧州電子臨床アウトカム評価(eCOA)
- コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の成長は、医療と製薬研究における正確でリアルタイムなデータ収集と患者モニタリングの改善の必要性に牽引され、臨床試験における電子患者報告アウトカム(ePRO)とeCOAソリューションの採用が増加していることが主な要因です。
- 臨床試験プロセスの合理化、規制遵守、効率的なデータ管理に対する需要の高まりにより、コンテンツライセンスソリューションの電子臨床結果評価(eCOA)の導入が加速し、業界の成長が大幅に促進されています。
- 英国は、コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)において、確立された医療インフラ、デジタル臨床試験技術の積極的な導入、そして電子的な患者アウトカム追跡に対する強力な規制支援に支えられ、2025年には約38.7%という最大の収益シェアを獲得し、市場をリードしました。英国では、クラウドベースのプラットフォーム、モバイルデータ収集、そして集中型臨床試験管理システムとの統合におけるイノベーションを背景に、臨床試験全体におけるeCOA導入が大幅に増加しています。
- ドイツは、予測期間中、コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)において最も急速な成長が見込まれる地域であり、2桁のCAGR(年平均成長率)で力強い成長が見込まれています。この成長は、臨床試験活動の増加、医療費の増加、デジタルヘルスソリューションへのアクセス拡大、そして病院、研究センター、製薬企業における電子データキャプチャおよび患者報告アウトカム技術の導入拡大によって牽引されています。
- クラウドベースのソリューションセグメントは、拡張可能な展開、リモートアクセスの容易さ、複数のデバイスとの統合により、2025年には収益シェア45.3%を占める。
コンテンツライセンス市場セグメンテーションのレポート範囲と電子臨床アウトカム評価(eCOA)
|
属性 |
コンテンツライセンスの主要市場インサイトのための電子臨床アウトカム評価(eCOA) |
|
対象セグメント |
|
|
対象国 |
ヨーロッパ
|
|
主要な市場プレーヤー |
|
|
市場機会 |
|
|
付加価値データ情報セット |
Data Bridge Market Research がまとめた市場レポートには、市場価値、成長率、セグメンテーション、地理的範囲、主要プレーヤーなどの市場シナリオに関する洞察に加えて、専門家による詳細な分析、患者の疫学、パイプライン分析、価格分析、規制の枠組みも含まれています。 |
欧州コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の動向
デジタル臨床試験ソリューションの導入増加
- コンテンツライセンス市場におけるグローバルeCOAの主なトレンドは、効率的でリアルタイムかつ患者中心のデータ収集の必要性から、デジタルおよびリモート臨床試験ソリューションの採用が増加していることです。
- 例えば、2023年3月、CRF Health(現在はSignant Healthの一部)は、eCOAプラットフォームをヨーロッパ全体に拡張し、完全に分散化された臨床試験をサポートし、複数の言語と研究プロトコルにわたる電子患者報告アウトカム(ePRO)の収集を可能にしました。
- デジタルeCOAツールは、従来の紙ベースの方法と比較して、エラーを減らし、データ収集を加速し、患者のコンプライアンスを向上させます。
- COVID-19パンデミックはこの傾向を加速させ、遠隔患者モニタリングと非接触データ収集の必要性を浮き彫りにし、パンデミック後も継続すると予想される。
- 製薬会社や開発業務受託機関(CRO)は、デジタルバイオマーカーやウェアラブルデバイス向けの電子臨床結果評価など、他のデジタル臨床試験技術とeCOAプラットフォームを統合するケースが増えています。
コンテンツライセンス市場の動向に関する欧州電子臨床アウトカム評価(eCOA)
ドライバ
患者中心の臨床試験への注目の高まり
- 臨床試験における患者中心主義の高まりにより、eCOAプラットフォームの採用が促進され、患者報告アウトカム(PRO)、症状追跡、健康関連の生活の質のデータをリアルタイムで取得することが可能になっています。
- 例えば、2024年7月、パレクセルインターナショナルは、ヨーロッパ全域の腫瘍学試験向けにカスタマイズされた新しいeCOAソリューションをリリースしました。これにより、患者はウェブまたはモバイルインターフェースを使用して自宅から直接結果を報告できるようになり、エンゲージメントと維持が向上しました。
- 欧州医薬品庁(EMA)を含む規制当局は、医薬品の承認申請にデジタルPRO収集を推奨する傾向が強まっており、より広範な導入を促している。
- 高品質で標準化された縦断的データをリモートで取得できるため、スポンサーは試験設計を最適化し、サイトの負担を軽減できます。
- 電子データキャプチャ(EDC)システムと集中型試験管理プラットフォームとの統合により、臨床試験スポンサーとCROにシームレスなワークフローが提供され、採用がさらに強化されます。
抑制/挑戦
データプライバシー、規制遵守、実装コスト
- eCOA市場は、データプライバシー、GDPRコンプライアンス、高い実装コストに関連する課題に直面しており、世界中での導入を遅らせる可能性があります。
- 例えば、2022年9月には、ヨーロッパの複数のCROが、厳格なデータ保護規制と安全な患者データ保管の必要性により、ドイツとフランスでのeCOAソリューションの導入が遅れていると報告した。
- 現地の法律、規制ガイドライン、検証要件への準拠を確保することは、特に多国籍試験の場合、eCOAの実装を複雑化させます。
- さらに、人材のトレーニングやソフトウェアの検証など、既存の臨床試験システムとの統合コストは高額になる可能性があり、中小規模のCROやスポンサーにとって障壁となる。
- これらの課題に対処するには、強力なサイバーセキュリティ、規制の整合、そして長期的な市場の成長を支える費用対効果の高いスケーラブルな展開戦略への投資が必要です。
欧州コンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)の範囲
市場は、製品、アプローチ、エンドユーザー、プラットフォームに基づいてセグメント化されています。
- 製品別
製品別に見ると、コンテンツライセンス市場向け電子臨床アウトカム評価(eCOA)市場は、オンプレミスソリューション、クラウドベースソリューション、Webベースソリューションに分類されます。クラウドベースソリューションは、スケーラブルな導入、リモートアクセスの容易さ、複数デバイスとの統合により、2025年には45.3%の収益シェアを占め、市場を牽引しました。クラウドプラットフォームは、スポンサー、CRO、臨床試験実施機関がデータを一元管理し、コンプライアンスを強化し、IT経費を削減することを可能にします。複数施設での臨床試験における高い導入率、強力なセキュリティプロトコル、リアルタイムレポートが、この市場シェアをさらに押し上げています。サブスクリプションベースのモデルの柔軟性、規制への適合性、EDCおよびePROシステムとの統合も、成長を支えています。大手製薬会社は、グローバル試験においてクラウドソリューションを好んでいます。COVID-19パンデミックは、リモートモニタリングのニーズにより導入を加速させました。稼働時間の改善とベンダーサポートの強化は、市場シェアを強化します。施設間の標準化された検証は信頼性を確保します。コスト効率とワークフローの最適化は、リーダーシップをさらに推進します。強化された分析機能とダッシュボード機能は、エンドユーザーを惹きつけています。モバイルアプリとの統合により、患者のコンプライアンスが向上します。全体として、これらの要因が優位性を維持しています。
オンプレミスソリューションセグメントは、社内データ管理とカスタマイズを必要とする組織に牽引され、2026年から2033年にかけて14.8%という最も高いCAGRを達成すると予想されています。厳格なデータガバナンスを備えた病院、CRO、バイオテクノロジー企業は、オンプレミスシステムを導入しています。従来のITインフラストラクチャとの統合が魅力を高めます。機密性の高い臨床データに対する高度なセキュリティ要件が導入を促進します。厳格なデータプライバシー規制のある地域での需要の高まりが成長を後押しします。高度なレポート機能と分析機能により、運用効率が向上します。エンタープライズ規模の導入により、利用が加速します。カスタマイズ可能なモジュールが利用可能であることは、大規模なスポンサーを惹きつけます。社内ITサポートにより、堅牢なメンテナンスが保証されます。ハイブリッド導入オプションのニーズの高まりが、拡張を補完します。個別化医療の治験への製薬投資により、導入がさらに促進されます。トレーニングと技術サポートにより、実装が強化されます。FDAおよびEMAコンプライアンスに関する規制の整合性により、導入が加速します。
- アプローチ別
アプローチに基づいて、市場はClinRO、PRO、ObsRO、およびPerfOに分類されます。患者報告アウトカム(PRO)セグメントは、規制申請、患者中心の試験、リアルワールドエビデンス研究での使用の増加に牽引され、2025年には42.1%の収益シェアで優位に立つでしょう。PROを使用すると、患者の健康状態、治療満足度、および生活の質の指標を直接測定できます。モバイルアプリやクラウドプラットフォームとの統合により、採用が促進されます。FDAとEMAからの強力なガイドラインサポートにより、需要が強化されます。慢性疾患と腫瘍学の試験の有病率が高いことが、使用を促進します。臨床エンドポイントはますますPROデータに依存するようになっています。多言語サポートにより、グローバル展開が拡大します。自動リマインダーによりコンプライアンスが向上します。頻繁なデータ収集により、データ量と有用性が向上します。eCOA、eDiary、ウェアラブルデバイスとの統合により、ワークフローが強化されます。PROベースのエンドポイントへの製薬会社の投資により、採用が加速します。
ObsROセグメントは、希少疾患、小児科、および介護者報告アウトカムにおける導入の増加により、2026年から2033年にかけて15.6%という最も高いCAGRで成長すると予想されています。観察者報告データは、自己報告ができない集団における測定を強化します。小児および高齢者研究の増加が需要を牽引します。遠隔モニタリングプラットフォームとの統合が導入を促進します。製薬会社とバイオテクノロジー企業による希少疾患試験への投資が事業拡大を支えます。複数施設の標準化がデータの信頼性を向上させます。クラウドおよびWebソリューションが導入を加速します。モバイル対応の観察者報告はコンプライアンスを強化します。新興市場ではObsROアプローチの導入が進んでいます。ObsROエンドポイントの規制当局による承認が成長を後押しします。トレーニングと施設サポートが導入を促進します。技術の進歩が手作業による入力ミスを削減します。多様な利害関係者による試験の価値が高いことが成長を加速させます。
- エンドユーザー別
エンドユーザーに基づいて、市場は商業サービスプロバイダー、病院および移植センター、研究機関、学術機関に分類されます。病院および移植センターセグメントは、広範な臨床試験活動、大規模な患者集団、および統合された成果評価システムの必要性により、2025年には47.2%の収益シェアで支配的でした。病院は、慢性疾患管理、腫瘍学の試験、および外科的成果追跡のためにeCOAを実装しています。多施設試験での高い採用率は、使用を強化します。EHRおよびEMRシステムとの統合は、ワークフローの効率を高めます。臨床成果データ収集の規制義務は、需要を押し上げます。大規模なトレーニングおよびサポートプログラムが採用を保証します。データセキュリティとHIPAA / GDPR標準への準拠は、信頼を強化します。マルチデバイスサポートは、患者と臨床医のエンゲージメントを向上させます。リアルタイム分析は運用上の意思決定をサポートします。CROとの提携は展開を拡大します。遠隔患者モニタリングは範囲を拡大します。病院ベースの臨床研究への投資はリーダーシップを推進します。継続的な改善プログラムが優位性を維持します。
商業サービスプロバイダーセグメントは、臨床試験のアウトソーシングの傾向と専門的なeCOA管理の需要の高まりにより、2026年から2033年にかけて16.3%という最も高いCAGRで成長すると予想されています。CROと臨床ベンダーは、マルチサイト試験向けのクラウドおよびWebベースのソリューションを提供しています。腫瘍学、神経学、希少疾患における受託研究の増加が成長を促進しています。サービス提供の柔軟性は、中規模および小規模の製薬会社のクライアントを惹きつけています。高度なレポートと分析は試験の効率を向上させます。新興市場への拡大は導入を後押しします。トレーニングとリモートサポートは導入の障壁を軽減します。EDCおよびPROシステムとの統合はシームレスなワークフローを保証します。データセキュリティと規制遵守は引き続き重要な推進力です。グローバル試験の拡張性が利用を加速します。スポンサーとの戦略的パートナーシップは市場範囲を拡大します。モバイルとウェアラブルの統合におけるイノベーションは、急速な導入を促進します。
- プラットフォーム別
プラットフォームに基づいて、市場は、開発業務委託機関、製薬およびバイオ医薬品企業、医療機器メーカー、病院および臨床検査室、コンサルティングサービス企業、研究および学術機関、その他に分類されます。製薬およびバイオ医薬品企業セグメントは、大規模な臨床開発プログラム、精密医療試験の採用、および規制申請のための電子結果データへの依存により、2025年には44.7%の収益シェアで優位に立つでしょう。製薬会社は、腫瘍学、心臓病学、および慢性疾患の研究のための統合eCOAプラットフォームに投資しています。大量の試験とグローバルな運用が優位性を支えています。EDC、PRO、およびウェアラブルデバイスとの統合により、ワークフローが合理化されます。規制遵守が採用を促進します。集中化されたデータ管理は試験の効率を高めます。長期的なベンダーパートナーシップはリーダーシップを強化します。マルチデバイスおよびマルチサイトの展開は使用をサポートします。クラウドベースのソリューションはアクセシビリティを向上させます。コンパニオン診断への投資は、プラットフォームの利用率を高めます。リアルタイムレポートは意思決定を強化します。高度な分析は医薬品開発プログラムを加速します。
医薬品開発業務受託機関(CRO)セグメントは、臨床試験のアウトソーシング、試験の複雑性の増大、そしてフルサービスのeCOA管理に対する需要の高まりを背景に、2026年から2033年にかけて15.8%という最も高いCAGRで成長すると予想されています。CROは、多国籍試験向けに拡張可能なクラウドベースのeCOAプラットフォームを提供しています。新興市場での急速な導入が成長を加速させています。スポンサーシステムとの統合により、運用効率が向上します。高度な分析とダッシュボードにより、試験に関する洞察が深まります。柔軟な導入モデルにより、中規模および小規模の製薬会社の顧客を惹きつけています。トレーニングと技術サポートにより、導入が促進されます。世界的な規制の整合性により、信頼性が向上します。複数の治療領域への導入により、事業拡大が促進されます。モバイルおよびリモートレポートにより、コンプライアンスが向上します。病院や学術機関との戦略的提携により、プレゼンスが強化されます。全体として、これらの要因が力強い成長を促進しています。
欧州コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)地域分析
- 欧州のコンテンツライセンス市場における電子臨床アウトカム評価(eCOA)は、予測期間を通じて大幅なCAGRで拡大すると予測されています。
- デジタル臨床試験ソリューションの導入増加、厳格な規制サポート、効率的な患者アウトカム追跡の需要増加により、
- 成長は、クラウドベースのプラットフォーム、モバイルデータ収集、電子患者報告アウトカムの統合、そして医療インフラの強化と臨床研究のデジタル化への地域の重点によって推進されている。
英国電子臨床アウトカム評価(eCOA)コンテンツライセンス市場インサイト
英国のコンテンツライセンス型電子臨床アウトカム評価(eCOA)市場は、確立された医療インフラ、デジタル臨床試験技術の積極的な導入、そして電子的な患者アウトカム追跡に対する強力な規制支援に支えられ、2025年には約38.7%という最大の収益シェアでコンテンツライセンス型電子臨床アウトカム評価(eCOA)市場を席巻しました。この大幅な成長は、クラウドベースのプラットフォーム、モバイルデータ収集、そして集中型臨床試験管理システムとのシームレスな統合におけるイノベーションによって推進されており、より効率的かつ正確な患者アウトカム測定を可能にしています。
ドイツ コンテンツライセンス市場インサイト向け電子臨床アウトカム評価(eCOA)
ドイツのコンテンツライセンス向け電子臨床アウトカム評価(eCOA)市場は、予測期間中にコンテンツライセンス向け電子臨床アウトカム評価(eCOA)市場において最も急速な成長が見込まれ、2桁のCAGR(年平均成長率)で堅調な成長が見込まれています。この成長は、臨床試験活動の増加、医療費の増加、デジタルヘルスソリューションへのアクセス拡大、そして病院、研究センター、製薬会社における電子データキャプチャおよび患者報告アウトカム技術の導入拡大によって牽引されています。さらに、ドイツが技術革新とデジタルヘルスケアインフラを重視していることも、市場の急速な拡大を後押ししています。
欧州電子臨床アウトカム評価(eCOA)コンテンツライセンス市場シェア
コンテンツライセンス業界向けの電子臨床結果評価 (eCOA) は、主に次のような定評ある企業によって主導されています。
• Medidata Solutions, Inc. (米国)
• CRF Health (英国)
• Signant Health (米国)
• Clinion (米国)
• Celegence (米国)
• Icon plc (アイルランド)
• PPD, Inc. (米国)
• Veeva Systems (米国)
• Oracle Health Sciences (米国)
• Synteract (米国)
• Bioclinica, Inc. (米国)
• Complion (米国)
• Curebase (米国)
• ClinOne (米国)
• CRF Bracket (米国)
• Datatrak International (米国)
• Electronic Data Capture, LLC (米国)
• PAREXEL International (米国)
• Health Solutions International (英国)
欧州コンテンツライセンス市場における電子臨床アウトカム評価(eCOA)の最新動向
- 2023年6月、ICON plcは、患者向けモバイルアプリ、eConsent、eCOA、在宅サービス向けの直接データキャプチャ、デジタルヘルステクノロジー管理を含む統合ソリューションであるICONデジタルプラットフォームをリリースしました。これにより、臨床試験全体での患者エンゲージメントとデータ収集が合理化され、eCOA機能のより広範なデジタル臨床試験運用への大幅な拡張が実現しました。
- 2023年7月、Signant HealthはDSG, Inc.を買収し、eCOAとハイブリッド試験技術ポートフォリオを拡張して強化されたEDC/DDC機能を追加し、特にヨーロッパにおける複雑な臨床研究環境における存在感を強化しました。
- 2023年11月、Clinical Inkは、SPUR行動診断ツールをeCOAおよびデジタルバイオマーカースイートと統合することで患者エンゲージメントソリューションを拡張し、患者の行動に関するより深い洞察を提供し、試験全体にわたる臨床結果の総合的な評価を改善しました。
- 2024年11月、uMotifはClinOneの買収を完了し、eCOA/ePRO機能とサイトの生産性および同意管理ツールを統合して、管理オーバーヘッドを削減し、試験エンゲージメントの効率を高める統合プラットフォームを構築しました。
- 2025年2月、YPrimeはeCOA 7.xプラットフォームの一部として自動データ変更フォーム(DCF)機能の導入を発表し、合理化された効率的な臨床データ管理を提供し、試験データワークフローの精度を向上させました。
- 2025年、メダブル社はエベレストグループのライフサイエンスeCOA製品PEAKマトリックス評価においてリーダーに選出され、AIイノベーション、リアルタイム分析、マルチモーダルデータキャプチャによる臨床結果評価の合理化と患者エンゲージメントの強化が認められました。
SKU-
世界初のマーケットインテリジェンスクラウドに関するレポートにオンラインでアクセスする
- インタラクティブなデータ分析ダッシュボード
- 成長の可能性が高い機会のための企業分析ダッシュボード
- カスタマイズとクエリのためのリサーチアナリストアクセス
- インタラクティブなダッシュボードによる競合分析
- 最新ニュース、更新情報、トレンド分析
- 包括的な競合追跡のためのベンチマーク分析のパワーを活用
調査方法
データ収集と基準年分析は、大規模なサンプル サイズのデータ収集モジュールを使用して行われます。この段階では、さまざまなソースと戦略を通じて市場情報または関連データを取得します。過去に取得したすべてのデータを事前に調査および計画することも含まれます。また、さまざまな情報ソース間で見られる情報の不一致の調査も含まれます。市場データは、市場統計モデルと一貫性モデルを使用して分析および推定されます。また、市場シェア分析と主要トレンド分析は、市場レポートの主要な成功要因です。詳細については、アナリストへの電話をリクエストするか、お問い合わせをドロップダウンしてください。
DBMR 調査チームが使用する主要な調査方法は、データ マイニング、データ変数が市場に与える影響の分析、および一次 (業界の専門家) 検証を含むデータ三角測量です。データ モデルには、ベンダー ポジショニング グリッド、市場タイムライン分析、市場概要とガイド、企業ポジショニング グリッド、特許分析、価格分析、企業市場シェア分析、測定基準、グローバルと地域、ベンダー シェア分析が含まれます。調査方法について詳しくは、お問い合わせフォームから当社の業界専門家にご相談ください。
カスタマイズ可能
Data Bridge Market Research は、高度な形成的調査のリーダーです。当社は、既存および新規のお客様に、お客様の目標に合致し、それに適したデータと分析を提供することに誇りを持っています。レポートは、対象ブランドの価格動向分析、追加国の市場理解 (国のリストをお問い合わせください)、臨床試験結果データ、文献レビュー、リファービッシュ市場および製品ベース分析を含めるようにカスタマイズできます。対象競合他社の市場分析は、技術ベースの分析から市場ポートフォリオ戦略まで分析できます。必要な競合他社のデータを、必要な形式とデータ スタイルでいくつでも追加できます。当社のアナリスト チームは、粗い生の Excel ファイル ピボット テーブル (ファクト ブック) でデータを提供したり、レポートで利用可能なデータ セットからプレゼンテーションを作成するお手伝いをしたりすることもできます。