Global Covid 19 Diagnostics Market
Tamaño del mercado en miles de millones de dólares
Tasa de crecimiento anual compuesta (CAGR) :
% 
 USD
58.90 Billion
USD
109.03 Billion
2024
2032
USD
58.90 Billion
USD
109.03 Billion
2024
2032
| 2025 –2032 | |
| USD 58.90 Billion | |
| USD 109.03 Billion | |
|
|
|
Segmentación del mercado global de diagnóstico de COVID-19, por tipo de prueba (ensayos moleculares, inmunoensayos serológicos y pruebas de diagnóstico auxiliares), producto (kits de reacción en cadena de la polimerasa, kits de pruebas en el punto de atención (POC), inmunoensayo, instrumentos, reactivos y kits), tecnología (reacción en cadena de la polimerasa (PCR), ensayo inmunoabsorbente ligado a enzimas (ELISA), inmunoensayo de flujo lateral (LFIA) y otros), tipo de muestra (hisopos orofaríngeos y nasofaríngeos, hisopos nasales, sangre y otros), entorno (basado en laboratorio y en el punto de atención), usuario final (hospitales, laboratorios de salud pública, laboratorios privados o comerciales, clínicas de atención de urgencia, laboratorios médicos): tendencias de la industria y pronóstico hasta 2032
Análisis del mercado de diagnóstico de COVID-19
Los Centros para el Control y la Prevención de Enfermedades (CDC) han desarrollado dos pruebas de laboratorio para identificar el SARS-CoV-2, el virus que causa la COVID-19. El panel de diagnóstico de RT-PCR en tiempo real del nuevo coronavirus 2019 (2019-nCoV) de los CDC, que detecta el SARS-CoV-2 en muestras respiratorias, fue la primera prueba distribuida para el diagnóstico de la COVID-19 y se lanzó en febrero de 2020. En julio de 2020, los CDC lanzaron el ensayo multiplexado de influenza SARS-CoV-2 (Flu SC2) de los CDC, que permite a los laboratorios de salud pública realizar tres pruebas en un solo pocillo de reacción. El Flu SC2 Multiplex utiliza menos reactivos de prueba, tiene un mayor rendimiento y proporciona resultados precisos para la presencia de ácido nucleico de SARS-CoV-2, influenza A y influenza B en una muestra de paciente.
Tamaño del mercado de diagnóstico de COVID-19
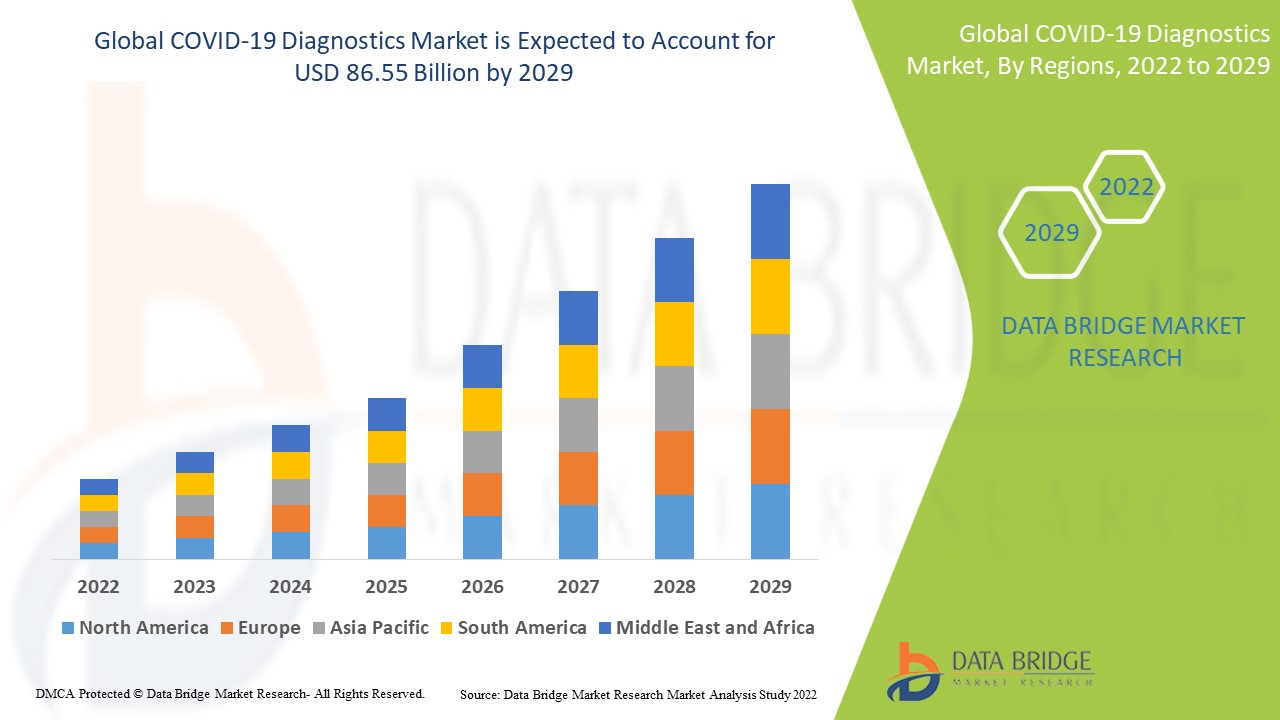
El tamaño del mercado global de diagnóstico de COVID-19 se valoró en USD 58,90 mil millones en 2024 y se proyecta que alcance los USD 109,03 mil millones para 2032, con una CAGR del 8,00% durante el período de pronóstico de 2025 a 2032.
Tendencias del mercado de diagnóstico de COVID-19
"Adopción rápida de soluciones de pruebas rápidas y en el hogar"
Una de las tendencias clave en el mercado mundial de diagnóstico de COVID-19 es la creciente adopción de soluciones de pruebas rápidas y en el hogar. Con la creciente necesidad de pruebas rápidas y convenientes, especialmente en respuesta al aumento de casos y la urgencia de detectar nuevas variantes, los diagnósticos de COVID-19 que ofrecen resultados rápidos se han vuelto cada vez más populares. Estas pruebas, incluidos los kits rápidos de antígenos y PCR para uso en el hogar, permiten a los consumidores hacerse la prueba ellos mismos con una incomodidad mínima y evitar largos tiempos de espera para obtener los resultados. La facilidad de acceso y la capacidad de realizar pruebas en el hogar sin necesidad de profesionales médicos especializados o instalaciones ha impulsado significativamente la demanda. Además, a medida que el mundo continúa luchando contra nuevas olas y variantes de COVID-19, se espera que siga creciendo la presión por soluciones de diagnóstico más rápidas, accesibles y rentables, lo que hace que estas tecnologías sean parte integral de la lucha en curso contra la pandemia.
Alcance del informe y segmentación del mercado
|
Atributos |
Perspectivas clave del mercado de diagnóstico de COVID-19 |
|
Segmentación |
|
|
Países cubiertos |
EE. UU., Canadá y México en América del Norte, Alemania, Francia, Reino Unido, Países Bajos, Suiza, Bélgica, Rusia, Italia, España, Turquía, Resto de Europa en Europa, China, Japón, India, Corea del Sur, Singapur, Malasia, Australia, Tailandia, Indonesia, Filipinas, Resto de Asia-Pacífico (APAC) en Asia-Pacífico (APAC), Arabia Saudita, Emiratos Árabes Unidos, Sudáfrica, Egipto, Israel, Resto de Medio Oriente y África (MEA) como parte de Medio Oriente y África (MEA), Brasil, Argentina y Resto de América del Sur como parte de América del Sur. |
|
Actores clave del mercado |
QIAGEN (Alemania), F.Hoffmann-La Roche Ltd (Suiza), Seegene Inc. (Corea del Sur), SolGent Co. Ltd (Corea del Sur), Curetis (Alemania), KURBO INDUSTRIES LTD. (Japón), Devex (EE. UU.), Thermo Fisher Scientific Inc (EE. UU.), Mylab Discovery Solutions Pvt. Ltd (India), Abbott (EE. UU.), Getein Biotech, Inc (China), Biomaxima SA (Polonia), CTK Biotech, Inc (EE. UU.), CDC (EE. UU.), BGI (China), Luminex Corporation (EE. UU.), Avellino.com (EE. UU.), PerkinElmer Inc (EE. UU.), Danaher (EE. UU.), Thermo Fisher Scientific Inc. (EE. UU.) |
|
Oportunidades de mercado |
|
Definición del mercado de diagnóstico de COVID-19
El nuevo coronavirus es un coronavirus de ARN monocatenario que se parece al SARS-CoV existente. Se propaga por contacto cercano con una persona infectada y se propaga principalmente a través de gotitas respiratorias producidas al toser y estornudar. El coronavirus, que ahora es una epidemia mundial, se descubrió por primera vez en la zona china de Wuhan. También se lo conoce como enfermedad por coronavirus o COVID-19. La RT-PCR, la amplificación isotérmica de ácidos nucleicos, la detección de anticuerpos y otras tecnologías se utilizan en los kits de prueba para la prueba de COVID-19, que se utiliza para identificar el virus SARS-CoV-2. Las pruebas serológicas se emplean para la vigilancia de la población, el diagnóstico y la identificación de anticuerpos.
Dinámica del mercado de diagnóstico de COVID-19
Conductores
La necesidad de kits de prueba en los hospitales es un factor impulsor
La necesidad de kits de prueba de coronavirus se ha expandido junto con la propagación del coronavirus. Con la ayuda de los kits de prueba, la identificación del coronavirus se ha vuelto más crucial que nunca para controlar la propagación de la infección e impulsar la expansión del mercado. Solo los laboratorios especializados que tienen licencia para realizar las pruebas incluidas en este kit, que son de tipo serológico y molecular. Como los kits se basan en técnicas que incluyen reacciones en cadena de la polimerasa en tiempo real, pruebas ELISA de IgM y ensayos de microneutralización, se toman muestras de la nariz, prueba de esputo, muestra de sangre, hisopado de garganta y aspirado nasal para realizar pruebas. La demanda de la industria está creciendo como resultado del brote mundial de coronavirus. A medida que aumenta rápidamente el número de pacientes en los hospitales, también aumenta la necesidad de kits de prueba en los hospitales para diagnosticar a los pacientes con síntomas, lo que impulsa aún más el crecimiento del mercado.
Avances tecnológicos en las pruebas rápidas de COVID-19
Los proveedores crearon una variedad de kits de prueba rápida innovadores, que incluyen vasos, tarjetas y kits de prueba inteligentes. Se utilizaron muestras de saliva en kits de prueba rápida indolora. Además, se lanzaron al mercado kits de prueba con resultados más rápidos. Las pruebas rápidas se prefieren a otros kits de prueba de COVID-19 como resultado de estos avances. Por ejemplo, Meril Diagnostics, una empresa médica internacional con operaciones en la India, produce la prueba rápida de antígenos CoviFind COVID-19 sin receta médica, que está disponible y ha recibido la aprobación del Consejo Indio de Investigación Médica (ICMR) para su uso rutinario en la India. Se espera que la introducción de pruebas de diagnóstico novedosas e innovadoras, como las pruebas serológicas inmunoenzimáticas, las pruebas rápidas de antígenos y las pruebas moleculares basadas en RT PCR, impulse la demanda de la industria.
Oportunidades
- Aumenta el número de pacientes con COVID-19
Con el rápido aumento del número de pacientes con COVID-19 en todo el mundo, los profesionales de la salud requieren un suministro constante de kits de diagnóstico, lo que se espera que tenga un impacto significativo en el mercado de diagnóstico de COVID-19 de 2025 a 2032. El creciente número de casos sospechosos y la necesidad de garantizar que los resultados de las pruebas sean correctos, lo que ha resultado en un aumento en la demanda de más kits, así como mayores preocupaciones de seguridad y la necesidad de diagnosticar y aislar a las personas infectadas, lo que se espera que impulse el crecimiento del mercado.
Restricciones/Desafíos
- Falta de conocimiento sobre el COVID-19
La falta de conocimiento sobre el COVID-19 y sus síntomas, la capacidad de aumentar en ciertas regiones en desarrollo entre los profesionales obstruirá la tasa de crecimiento del mercado. El tiempo requerido para el resultado es de más de 24 horas, lo que es un poco más largo y actuará como una restricción y desafiará aún más el crecimiento del mercado de Diagnóstico de COVID-19 en el período de pronóstico mencionado anteriormente. El aumento del número de resultados falsos positivos y falsos negativos es uno de los principales inconvenientes de las pruebas rápidas. Un conjunto de kits de prueba de COVID-19 contenía casos de hallazgos que eran tanto falsos positivos como falsos negativos. Cuando se verificó con pruebas alternativas de COVID-19, las personas con síntomas de COVID-19 dieron negativo y positivo. Estos incidentes provocaron que el uso de kits de prueba rápida de COVID-19 disminuyera en algunos países.
Este informe sobre el mercado de diagnóstico de COVID-19 proporciona detalles de los nuevos desarrollos recientes, regulaciones comerciales, análisis de importación y exportación, análisis de producción, optimización de la cadena de valor, participación de mercado, impacto de los actores del mercado nacional y localizado, analiza las oportunidades en términos de bolsillos de ingresos emergentes, cambios en las regulaciones del mercado, análisis estratégico del crecimiento del mercado, tamaño del mercado, crecimientos del mercado de categorías, nichos de aplicación y dominio, aprobaciones de productos, lanzamientos de productos, expansiones geográficas, innovaciones tecnológicas en el mercado. Para obtener más información sobre el mercado de diagnóstico de COVID-19, comuníquese con Data Bridge Market Research para obtener un informe de analista, nuestro equipo lo ayudará a tomar una decisión de mercado informada para lograr el crecimiento del mercado.
Alcance del mercado de diagnóstico de COVID-19
El mercado de diagnóstico de COVID-19 está segmentado en función del tipo de prueba, el producto, la tecnología, el tipo de muestra, el entorno y el usuario final. El crecimiento entre estos segmentos le ayudará a analizar los segmentos de crecimiento reducido en las industrias y brindará a los usuarios una valiosa descripción general del mercado y conocimientos del mercado para ayudarlos a tomar decisiones estratégicas para identificar las principales aplicaciones del mercado.
Tipo de prueba
- Ensayos moleculares
- Inmunoensayos serológicos
- Pruebas diagnósticas complementarias
Producto
- Kits de reacción en cadena de la polimerasa
- Kits de pruebas en el punto de atención (POC)
- Inmunoensayo
- Instrumentos
- Reactivos y kits
Tecnología
- Reacción en cadena de la polimerasa (PCR)
- Ensayo inmunoabsorbente ligado a enzimas (ELISA)
- Inmunoensayo de flujo lateral (LFIA)
- Otros
Tipo de muestra
- Hisopados orofaríngeos y nasofaríngeos
- Hisopos nasales
- Sangre
- Otros
Configuración
- Basado en laboratorio
- Punto de atención
Usuario final
- Hospitales
- Laboratorios de salud pública
- Laboratorios privados o comerciales
- Clínicas de atención de urgencia
- Laboratorios médicos
Análisis regional del mercado de diagnóstico de COVID-19
Se analiza el mercado de diagnóstico de COVID-19 y se proporcionan información y tendencias del tamaño del mercado por país, tipo de prueba, producto, tecnología, tipo de muestra, configuración y usuario final como se menciona anteriormente.
Los países cubiertos en el informe del mercado de diagnóstico de COVID-19 son EE. UU., Canadá y México en América del Norte, Alemania, Francia, Reino Unido, Países Bajos, Suiza, Bélgica, Rusia, Italia, España, Turquía, Resto de Europa en Europa, China, Japón, India, Corea del Sur, Singapur, Malasia, Australia, Tailandia, Indonesia, Filipinas, Resto de Asia-Pacífico (APAC) en Asia-Pacífico (APAC), Arabia Saudita, Emiratos Árabes Unidos, Sudáfrica, Egipto, Israel, Resto de Medio Oriente y África (MEA) como parte de Medio Oriente y África (MEA), Brasil, Argentina y Resto de América del Sur como parte de América del Sur.
América del Norte domina el mercado de diagnóstico de COVID-19 debido al sistema de atención médica bien establecido y la presencia de numerosas compañías farmacéuticas existentes en esta región en particular.
Se espera que Asia-Pacífico crezca a la tasa de crecimiento más alta en el período de pronóstico de 2025 a 2032 debido al aumento de casos de coronavirus junto con la presencia de varios actores de la industria.
La sección de países del informe también proporciona factores de impacto de mercado individuales y cambios en la regulación en el mercado a nivel nacional que afectan las tendencias actuales y futuras del mercado. Puntos de datos como análisis de la cadena de valor aguas abajo y aguas arriba, tendencias técnicas y análisis de las cinco fuerzas de Porter, estudios de casos son algunos de los indicadores utilizados para pronosticar el escenario del mercado para países individuales. Además, la presencia y disponibilidad de marcas globales y sus desafíos enfrentados debido a la competencia grande o escasa de las marcas locales y nacionales, el impacto de los aranceles nacionales y las rutas comerciales se consideran al proporcionar un análisis de pronóstico de los datos del país.
Cuota de mercado de diagnóstico de COVID-19
El panorama competitivo del mercado proporciona detalles por competidor. Los detalles incluidos son una descripción general de la empresa, las finanzas de la empresa, los ingresos generados, el potencial de mercado, la inversión en investigación y desarrollo, las nuevas iniciativas de mercado, la presencia global, los sitios e instalaciones de producción, las capacidades de producción, las fortalezas y debilidades de la empresa, el lanzamiento de productos, la amplitud y variedad de productos, y el dominio de las aplicaciones. Los puntos de datos anteriores proporcionados solo están relacionados con el enfoque de las empresas en relación con el mercado.
Los líderes del mercado de diagnóstico de COVID-19 que operan en el mercado son:
- QIAGEN (Alemania)
- F.Hoffmann-La Roche Ltd (Suiza)
- Seegene Inc (Corea del Sur)
- SolGent Co. Ltd (Corea del Sur)
- Curetis (Alemania)
- KURBO INDUSTRIES LTD. (Japón)
- Devex (Estados Unidos)
- Thermo Fisher Scientific Inc (Estados Unidos)
- Mylab Discovery Solutions Pvt. Ltd (India)
- Abbott (Estados Unidos)
- Getein Biotech, Inc. (China)
- Biomaxima SA (Polonia)
- CTK Biotech, Inc. (Estados Unidos)
- CDC (Estados Unidos)
- BGI (China)
- Corporación Luminex (Estados Unidos)
- Avellino.com (Estados Unidos)
- PerkinElmer Inc (Estados Unidos)
- Danaher (Estados Unidos)
- Thermo Fisher Scientific Inc. (Estados Unidos)
Últimos avances en el mercado de diagnóstico de COVID-19
- En julio de 2021, Abbott lanzó la autoprueba de antígeno PanbioTM COVID-19 en India para ampliar su oferta de diagnóstico rápido a fin de satisfacer los requisitos de detección en el hogar, el trabajo y las clínicas.
- En marzo de 2021, Roche Diagnostics anunció la autorización de uso de emergencia (EUA) de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para la prueba rápida de antígeno COVID-19, que está destinada a ser utilizada por profesionales de la salud en situaciones de punto de atención con pacientes con COVID-19.
SKU-
Obtenga acceso en línea al informe sobre la primera nube de inteligencia de mercado del mundo
- Panel de análisis de datos interactivo
- Panel de análisis de empresas para oportunidades con alto potencial de crecimiento
- Acceso de analista de investigación para personalización y consultas
- Análisis de la competencia con panel interactivo
- Últimas noticias, actualizaciones y análisis de tendencias
- Aproveche el poder del análisis de referencia para un seguimiento integral de la competencia
Metodología de investigación
La recopilación de datos y el análisis del año base se realizan utilizando módulos de recopilación de datos con muestras de gran tamaño. La etapa incluye la obtención de información de mercado o datos relacionados a través de varias fuentes y estrategias. Incluye el examen y la planificación de todos los datos adquiridos del pasado con antelación. Asimismo, abarca el examen de las inconsistencias de información observadas en diferentes fuentes de información. Los datos de mercado se analizan y estiman utilizando modelos estadísticos y coherentes de mercado. Además, el análisis de la participación de mercado y el análisis de tendencias clave son los principales factores de éxito en el informe de mercado. Para obtener más información, solicite una llamada de un analista o envíe su consulta.
La metodología de investigación clave utilizada por el equipo de investigación de DBMR es la triangulación de datos, que implica la extracción de datos, el análisis del impacto de las variables de datos en el mercado y la validación primaria (experto en la industria). Los modelos de datos incluyen cuadrícula de posicionamiento de proveedores, análisis de línea de tiempo de mercado, descripción general y guía del mercado, cuadrícula de posicionamiento de la empresa, análisis de patentes, análisis de precios, análisis de participación de mercado de la empresa, estándares de medición, análisis global versus regional y de participación de proveedores. Para obtener más información sobre la metodología de investigación, envíe una consulta para hablar con nuestros expertos de la industria.
Personalización disponible
Data Bridge Market Research es líder en investigación formativa avanzada. Nos enorgullecemos de brindar servicios a nuestros clientes existentes y nuevos con datos y análisis que coinciden y se adaptan a sus objetivos. El informe se puede personalizar para incluir análisis de tendencias de precios de marcas objetivo, comprensión del mercado de países adicionales (solicite la lista de países), datos de resultados de ensayos clínicos, revisión de literatura, análisis de mercado renovado y base de productos. El análisis de mercado de competidores objetivo se puede analizar desde análisis basados en tecnología hasta estrategias de cartera de mercado. Podemos agregar tantos competidores sobre los que necesite datos en el formato y estilo de datos que esté buscando. Nuestro equipo de analistas también puede proporcionarle datos en archivos de Excel sin procesar, tablas dinámicas (libro de datos) o puede ayudarlo a crear presentaciones a partir de los conjuntos de datos disponibles en el informe.