Global Covid 19 Diagnostics Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
58.90 Billion
USD
109.03 Billion
2024
2032
USD
58.90 Billion
USD
109.03 Billion
2024
2032
| 2025 –2032 | |
| USD 58.90 Billion | |
| USD 109.03 Billion | |
|
|
|
Globale Marktsegmentierung für COVID-19-Diagnostika nach Testtyp (Molekulartests, serologische Immuntests und ergänzende diagnostische Tests), Produkt (Polymerase-Kettenreaktions-Kits, Point-of-Care (POC)-Testkits, Immuntests, Instrumente, Reagenzien und Kits), Technologie (Polymerase-Kettenreaktion (PCR), Enzyme Linked Immunosorbent Assay (ELISA), Lateral Flow Immunoassay (LFIA) und andere), Probentyp (Oropharyngeal- und Nasopharyngealabstriche, Nasenabstriche, Blut und andere), Setting (Labor- und Point-of-Care-Tests), Endnutzer (Krankenhäuser, öffentliche Gesundheitslabore, private oder kommerzielle Labore, Notfallkliniken, Arztlabore) – Branchentrends und Prognose bis 2032
COVID-19-Diagnostikmarktanalyse
Die Centers for Disease Control and Prevention (CDC) haben zwei Labortests zum Nachweis von SARS-CoV-2, dem Virus, das COVID-19 verursacht, entwickelt. Das CDC 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel, das SARS-CoV-2 in Atemwegsproben nachweist, war der erste Test zur COVID-19-Diagnose und wurde im Februar 2020 veröffentlicht. Im Juli 2020 veröffentlichte die CDC den CDC Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay, mit dem öffentliche Gesundheitslabore drei Tests in einer einzigen Reaktionskammer durchführen können. Der Flu SC2 Multiplex verwendet weniger Testreagenzien, hat einen höheren Durchsatz und liefert genaue Ergebnisse zum Vorhandensein von SARS-CoV-2-, Influenza A- und Influenza B-Nukleinsäure in einer Patientenprobe.
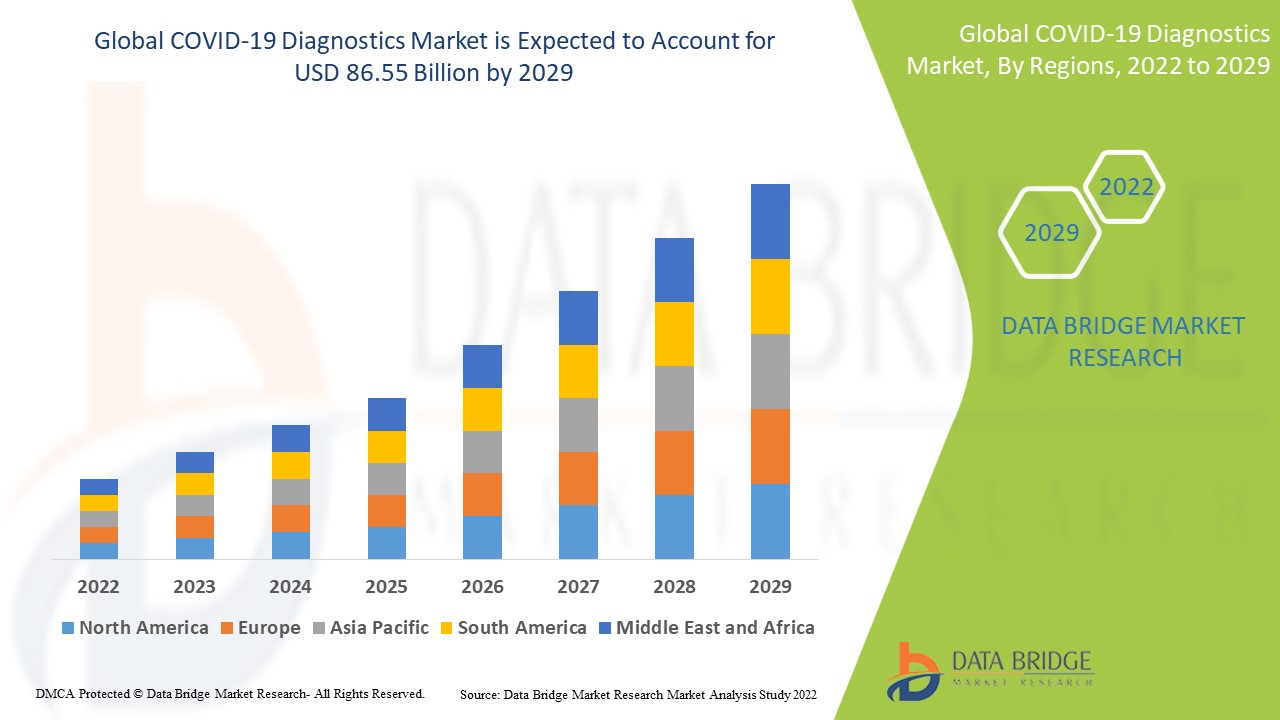
COVID-19-Diagnostikmarktgröße
Der globale Markt für COVID-19-Diagnostika hatte im Jahr 2024 einen Wert von 58,90 Milliarden US-Dollar und soll bis 2032 voraussichtlich 109,03 Milliarden US-Dollar erreichen, mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 8,00 % im Prognosezeitraum von 2025 bis 2032.
Markttrends für COVID-19-Diagnostika
„Schnelle Einführung von Heim- und Schnelltestlösungen“
Einer der wichtigsten Trends im globalen COVID-19-Diagnostikmarkt ist die zunehmende Nutzung von Heim- und Schnelltests. Mit dem steigenden Bedarf an schnellen und bequemen Tests, insbesondere angesichts steigender Fallzahlen und der Dringlichkeit, neue Varianten zu erkennen, erfreuen sich COVID-19-Diagnostika mit schnellen Ergebnissen zunehmender Beliebtheit. Diese Tests, darunter Antigen-Schnelltests und PCR-Kits für den Heimgebrauch, ermöglichen es Verbrauchern, sich mit minimalem Aufwand selbst zu testen und lange Wartezeiten auf Ergebnisse zu vermeiden. Der einfache Zugang und die Möglichkeit, Tests zu Hause ohne spezialisiertes medizinisches Fachpersonal oder medizinische Einrichtungen durchzuführen, haben die Nachfrage deutlich gesteigert. Da die Welt weiterhin gegen neue COVID-19-Wellen und -Varianten kämpft, wird der Bedarf an schnelleren, zugänglicheren und kostengünstigeren Diagnoselösungen voraussichtlich weiter zunehmen. Diese Technologien werden somit zu einem integralen Bestandteil des anhaltenden Kampfes gegen die Pandemie.
Berichtsumfang und Marktsegmentierung
|
Eigenschaften |
Wichtige Markteinblicke zur COVID-19-Diagnostik |
|
Segmentierung |
|
|
Abgedeckte Länder |
USA, Kanada und Mexiko in Nordamerika, Deutschland, Frankreich, Großbritannien, Niederlande, Schweiz, Belgien, Russland, Italien, Spanien, Türkei, Restliches Europa in Europa, China, Japan, Indien, Südkorea, Singapur, Malaysia, Australien, Thailand, Indonesien, Philippinen, Restlicher Asien-Pazifik-Raum (APAC) im Asien-Pazifik-Raum (APAC), Saudi-Arabien, Vereinigte Arabische Emirate, Südafrika, Ägypten, Israel, Restlicher Naher Osten und Afrika (MEA) als Teil des Nahen Ostens und Afrikas (MEA), Brasilien, Argentinien und Restliches Südamerika als Teil von Südamerika. |
|
Wichtige Marktteilnehmer |
QIAGEN (Deutschland), F.Hoffmann-La Roche Ltd (Schweiz), Seegene Inc. (Südkorea), SolGent Co. Ltd (Südkorea), Curetis (Deutschland), KURBO INDUSTRIES LTD. (Japan), Devex (USA), Thermo Fisher Scientific Inc (USA), Mylab Discovery Solutions Pvt. Ltd (Indien), Abbott (USA), Getein Biotech, Inc (China), Biomaxima SA (Polen), CTK Biotech, Inc (USA), CDC (USA), BGI (China), Luminex Corporation (USA), Avellino.com (USA), PerkinElmer Inc (USA), Danaher (USA), Thermo Fisher Scientific Inc. (USA) |
|
Marktchancen |
|
COVID-19-Diagnostikmarktdefinition
Das neuartige Coronavirus ist ein einzelsträngiges RNA-Coronavirus, das dem bekannten SARS-CoV ähnelt. Es verbreitet sich durch engen Kontakt mit infizierten Personen und hauptsächlich durch Tröpfcheninfektion beim Husten und Niesen. Das Coronavirus, das mittlerweile eine globale Epidemie darstellt, wurde erstmals im chinesischen Wuhan entdeckt. Es ist auch als Coronavirus-Erkrankung oder COVID-19 bekannt. RT-PCR, isotherme Nukleinsäureamplifikation, Antikörpernachweis und weitere Technologien werden in Testkits für den COVID-19-Test verwendet, der zur Identifizierung des SARS-CoV-2-Virus dient. Serologische Tests werden zur Bevölkerungsüberwachung, Diagnose und zum Nachweis von Antikörpern eingesetzt.
Marktdynamik für COVID-19-Diagnostika
Treiber
Bedarf an Testkits in Krankenhäusern ist ein Treiber
Der Bedarf an Coronavirus-Testkits ist mit der Verbreitung des Coronavirus gestiegen. Mithilfe von Testkits ist die Identifizierung des Coronavirus wichtiger denn je, um die Ausbreitung der Infektion einzudämmen und das Marktwachstum voranzutreiben. Nur spezialisierte Labore, die über eine Lizenz verfügen, die in diesem Kit enthaltenen serologischen und molekularen Tests durchzuführen, sind dazu berechtigt. Da die Kits auf Techniken wie Echtzeit-Polymerase-Kettenreaktionen, IgM-ELISA-Tests und Mikroneutralisationsassays basieren, werden zur Untersuchung Proben aus Nase, Sputum, Blutprobe, Rachenabstrich und Nasensekret entnommen. Die Nachfrage in dieser Branche wächst infolge des weltweiten Ausbruchs des Coronavirus. Da die Zahl der Krankenhauspatienten rapide zunimmt, steigt auch der Bedarf an Testkits in Krankenhäusern zur Diagnose von Patienten mit Symptomen, was das Marktwachstum weiter vorantreibt.
Technologische Fortschritte bei COVID-19-Schnelltests
Anbieter haben eine Vielzahl innovativer Schnelltests entwickelt, darunter Becher, Karten und Smart-Testkits. Speichelproben wurden für schmerzfreie Schnelltests verwendet. Zusätzlich kamen Testkits mit schnelleren Ergebnissen auf den Markt. Aufgrund dieser Entwicklungen werden Schnelltests anderen COVID-19-Testkits vorgezogen. Beispielsweise stellt Meril Diagnostics, ein internationales Medizinunternehmen mit Niederlassungen in Indien, den rezeptfreien CoviFind COVID-19 Rapid Antigen Self-Test her, der in Indien erhältlich ist und vom Indian Council of Medical Research (ICMR) für den Routineeinsatz zugelassen wurde. Die Einführung neuartiger und innovativer Diagnosetests, wie immunenzymatischer serologischer Tests, schneller Antigentests und RT-PCR-basierter molekularer Tests, dürfte die Branchennachfrage ankurbeln.
Gelegenheiten
- Steigende Zahl von COVID-19-Patienten
Angesichts der weltweit rapide steigenden Zahl von COVID-19-Patienten benötigen Angehörige der Gesundheitsberufe eine konstante Versorgung mit Diagnosekits, was voraussichtlich zwischen 2025 und 2032 erhebliche Auswirkungen auf den Markt für COVID-19-Diagnostika haben wird. Die steigende Zahl der Verdachtsfälle und die Notwendigkeit, die Richtigkeit der Testergebnisse sicherzustellen, haben zu einer erhöhten Nachfrage nach mehr Kits geführt, ebenso wie erhöhte Sicherheitsbedenken und die Notwendigkeit, infizierte Personen zu diagnostizieren und zu isolieren, was das Marktwachstum voraussichtlich ankurbeln wird.
Einschränkungen/Herausforderungen
- Mangelndes Wissen über COVID-19
Mangelndes Wissen über COVID-19 und seine Symptome sowie die Möglichkeit einer Zunahme der Fälle unter Fachleuten in bestimmten Entwicklungsregionen werden das Marktwachstum hemmen. Es dauert etwas länger als 24 Stunden, bis ein Ergebnis vorliegt, was das Wachstum des COVID-19-Diagnostikmarktes im oben genannten Prognosezeitraum hemmen und weiter behindern wird. Die erhöhte Anzahl falsch positiver und falsch negativer Ergebnisse ist einer der Hauptnachteile von Schnelltests. Eine Reihe von COVID-19-Testkits enthielt sowohl falsch positive als auch falsch negative Ergebnisse. Bei der Überprüfung mit alternativen COVID-19-Tests waren Personen mit COVID-19-Symptomen sowohl negativ als auch positiv. Diese Vorfälle führten in einigen Ländern zu einem Rückgang der Verwendung von COVID-19-Schnelltests.
Dieser Marktbericht zur COVID-19-Diagnostik enthält Details zu aktuellen Entwicklungen, Handelsbestimmungen, Import-Export-Analysen, Produktionsanalysen, Wertschöpfungskettenoptimierungen, Marktanteilen, dem Einfluss inländischer und lokaler Marktteilnehmer, analysiert Chancen in Bezug auf neue Umsatzfelder, Änderungen der Marktregulierung, strategische Marktwachstumsanalysen, Marktgröße, Kategoriemarktwachstum, Anwendungsnischen und Marktdominanz, Produktzulassungen, Produkteinführungen, geografische Expansion und technologische Innovationen. Für weitere Informationen zum COVID-19-Diagnostikmarkt kontaktieren Sie Data Bridge Market Research für ein Analysten-Briefing. Unser Team unterstützt Sie bei fundierten Marktentscheidungen und unterstützt Sie bei Ihrem Marktwachstum.
Marktumfang für COVID-19-Diagnostika
Der Markt für COVID-19-Diagnostika ist nach Testtyp, Produkt, Technologie, Probentyp, Umgebung und Endnutzer segmentiert. Das Wachstum dieser Segmente hilft Ihnen, schwache Wachstumssegmente in den Branchen zu analysieren und bietet den Nutzern einen wertvollen Marktüberblick und Markteinblicke, die ihnen helfen, strategische Entscheidungen zur Identifizierung zentraler Marktanwendungen zu treffen.
Testtyp
- Molekulare Assays
- Serologische Immunassays
- Ergänzende Diagnosetests
Produkt
- Polymerase-Kettenreaktions-Kits
- Point-of-Care (POC)-Testkits
- Immunassay
- Instrumente
- Reagenzien und Kits
Technologie
- Polymerase-Kettenreaktion (PCR)
- Enzyme Linked Immunosorbent Assay (ELISA)
- Lateral-Flow-Immunoassay (LFIA)
- Sonstiges
Probentyp
- Oropharyngeal- und Nasopharyngealabstriche
- Nasenabstriche
- Blut
- Sonstiges
Einstellung
- Laborbasiert
- Behandlungsort
Endbenutzer
- Krankenhäuser
- Öffentliche Gesundheitslabore
- Private oder kommerzielle Labore
- Notfallkliniken
- Arztlabore
Regionale Analyse des COVID-19-Diagnostikmarktes
Der Markt für COVID-19-Diagnostika wird analysiert und es werden Einblicke in die Marktgröße und Trends nach Land, Testtyp, Produkt, Technologie, Probentyp, Einstellung und Endbenutzer wie oben angegeben bereitgestellt.
Die im Marktbericht zur COVID-19-Diagnostik abgedeckten Länder sind die USA, Kanada und Mexiko in Nordamerika, Deutschland, Frankreich, Großbritannien, die Niederlande, die Schweiz, Belgien, Russland, Italien, Spanien, die Türkei, das übrige Europa in Europa, China, Japan, Indien, Südkorea, Singapur, Malaysia, Australien, Thailand, Indonesien, die Philippinen, der übrige asiatisch-pazifische Raum (APAC) im asiatisch-pazifischen Raum (APAC), Saudi-Arabien, die Vereinigten Arabischen Emirate, Südafrika, Ägypten, Israel, der übrige Nahe Osten und Afrika (MEA) als Teil des Nahen Ostens und Afrikas (MEA), Brasilien, Argentinien und der übrige Südamerika als Teil Südamerikas.
Nordamerika dominiert den Markt für COVID-19-Diagnostik aufgrund des gut etablierten Gesundheitssystems und der Präsenz zahlreicher Pharmaunternehmen in dieser Region.
Aufgrund der steigenden Zahl an Coronavirus-Fällen und der Präsenz mehrerer Branchenakteure wird für den asiatisch-pazifischen Raum im Prognosezeitraum 2025 bis 2032 die höchste Wachstumsrate erwartet.
Der Länderteil des Berichts enthält zudem Informationen zu einzelnen marktbeeinflussenden Faktoren und regulatorischen Veränderungen im Inland, die sich auf die aktuellen und zukünftigen Markttrends auswirken. Datenpunkte wie die Analyse der nachgelagerten und vorgelagerten Wertschöpfungskette, technische Trends, die Fünf-Kräfte-Analyse nach Porter sowie Fallstudien dienen unter anderem der Prognose des Marktszenarios für einzelne Länder. Auch die Präsenz und Verfügbarkeit globaler Marken und ihre Herausforderungen aufgrund starker oder geringer Konkurrenz durch lokale und inländische Marken sowie die Auswirkungen inländischer Zölle und Handelsrouten werden bei der Prognoseanalyse der Länderdaten berücksichtigt.
Marktanteil der COVID-19-Diagnostik
Die Wettbewerbslandschaft des Marktes bietet detaillierte Informationen zu den einzelnen Wettbewerbern. Zu den Details gehören Unternehmensübersicht, Unternehmensfinanzen, Umsatz, Marktpotenzial, Investitionen in Forschung und Entwicklung, neue Marktinitiativen, globale Präsenz, Produktionsstandorte und -anlagen, Produktionskapazitäten, Stärken und Schwächen des Unternehmens, Produkteinführung, Produktbreite und -umfang sowie Anwendungsdominanz. Die oben genannten Datenpunkte beziehen sich ausschließlich auf die Marktausrichtung der Unternehmen.
Die auf dem Markt tätigen Marktführer im Bereich COVID-19-Diagnostik sind:
- QIAGEN (Deutschland)
- F.Hoffmann-La Roche Ltd (Schweiz)
- Seegene Inc (Südkorea)
- SolGent Co. Ltd (Südkorea)
- Curetis (Deutschland)
- KURBO INDUSTRIES LTD. (Japan)
- Devex (USA)
- Thermo Fisher Scientific Inc (USA)
- Mylab Discovery Solutions Pvt. Ltd (Indien)
- Abbott (USA)
- Getein Biotech, Inc. (China)
- Biomaxima SA (Polen)
- CTK Biotech, Inc (USA)
- CDC (USA)
- BGI (China)
- Luminex Corporation (USA)
- Avellino.com (USA)
- PerkinElmer Inc (USA)
- Danaher (USA)
- Thermo Fisher Scientific Inc. (USA)
Neueste Entwicklungen auf dem COVID-19-Diagnostikmarkt
- Im Juli 2021 brachte Abbott den PanbioTM COVID-19-Antigen-Selbsttest in Indien auf den Markt, um sein Angebot an Schnelldiagnostik zu erweitern und den Screening-Anforderungen zu Hause, am Arbeitsplatz und in Kliniken gerecht zu werden.
- Im März 2021 gab Roche Diagnostics die Genehmigung der US-amerikanischen Food and Drug Administration (FDA) für die Notfallzulassung (EUA) für den COVID-19-Antigen-Schnelltest bekannt, der für den Einsatz durch medizinisches Fachpersonal in Point-of-Care-Situationen mit COVID-19-Patienten vorgesehen ist.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.