Europäischer G-CSF/PEG-G-CSF-Markt nach Indikation ( Neutropenie , Onkologie, chronische und Autoimmunerkrankungen, Blutkrankheiten, Wachstumshormonmangel und andere), Dosierung (Mono- und Kombinationstherapie), Verabreichungsweg (intravenös, subkutan), Verpackung (Einwegfläschchen und Fertigspritzen), Endverbraucher (Krankenhäuser und Kliniken, Forschungs- und akademische Institute, ambulante chirurgische Zentren und andere), Vertriebskanal (Krankenhausapotheke, Online-Apotheke, Einzelhandelsapotheke und andere) – Branchentrends und Prognose bis 2030.
Europa G-CSF/ PEG-G-CSF Marktanalyse und Einblicke
Die zunehmende Krebsprävention in Industrieländern und Regierungen haben gezielte Initiativen zur Aufklärung über eine frühzeitige Behandlung eingeführt, um den europäischen Absatzmarkt für G-CSF-Biosimilars zu fördern. Grafeel, Colstim, Neukine und Filcad, die zugelassene Biosimilars sind und zudem kostengünstig und in Entwicklungsländern leicht erhältlich sind, werden zu einem erheblichen Marktwachstum führen. China und Indien sind die Länder, in denen die Zahl der Krebspatienten zunimmt, was den europäischen Markt wahrscheinlich ankurbeln wird. Somit trägt die Verwendung von Biosimilars dazu bei, die Gesundheitskosten der Patienten im Vergleich zur Verwendung von Originalbiologika zu senken, was die Nachfrage auf dem europäischen Absatzmarkt für G-CSF-Biosimilars erhöht. Aufgrund der komplexen biologischen Herstellungsprozesse einzelner Biosimilars sind die Kosten von Biosimilars nicht so niedrig wie die von Generika. Die zunehmende Verbreitung von Autoimmun- und seltenen chronischen Krankheiten wird voraussichtlich das Wachstum des Segmentmarkts vorantreiben.
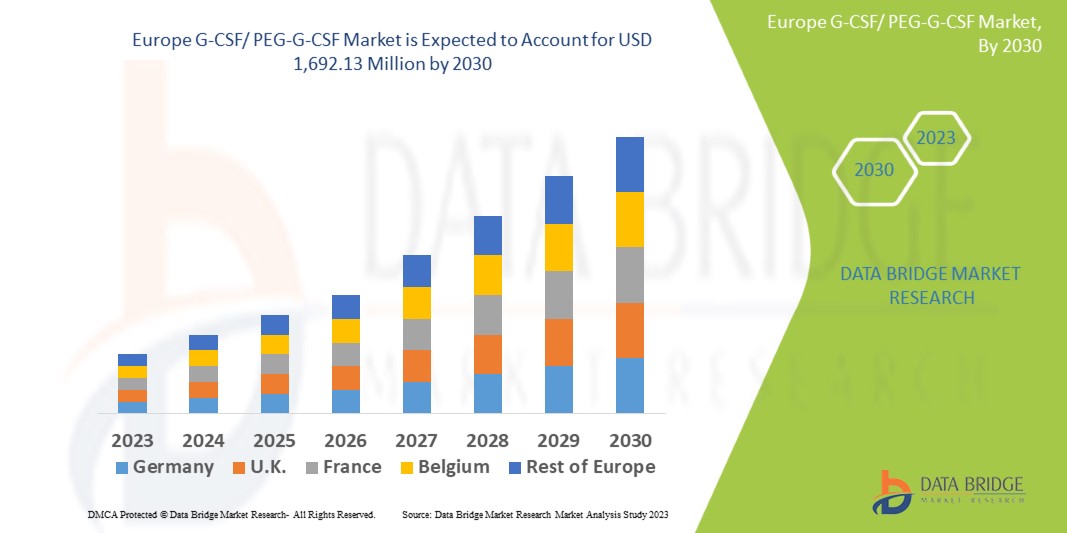
Data Bridge Market Research analysiert, dass der europäische G-CSF/PEG-G-CSF-Markt bis 2030 voraussichtlich einen Wert von 1.692,13 Millionen USD erreichen wird, was einer durchschnittlichen jährlichen Wachstumsrate von 5,1 % während des Prognosezeitraums entspricht. Dieser Marktbericht behandelt auch ausführlich Preisanalysen, Patentanalysen und technologische Fortschritte.
|
Berichtsmetrik |
Details |
|
Prognosezeitraum |
2023 bis 2030 |
|
Basisjahr |
2022 |
|
Historische Jahre |
2021 (anpassbar auf 2020–2015) |
|
Quantitative Einheiten |
Umsatz in Millionen USD, Preise in USD |
|
Abgedeckte Segmente |
Nach Indikation (Neutropenie, Onkologie, chronische und Autoimmunerkrankungen, Blutkrankheiten, Wachstumsharmonie-Mangel und andere), Dosierung (Mono- und Kombinationspräparate), Verabreichungsweg (intravenös, subkutan), Verpackung (Einwegfläschchen und vorgefüllte Spritzen), Endverbraucher (Krankenhäuser und Kliniken, Forschungs- und akademische Institute, ambulante chirurgische Zentren und andere), Vertriebskanal (Krankenhausapotheke, Online-Apotheke, Einzelhandelsapotheke und andere) |
|
Abgedeckte Länder |
Deutschland, Großbritannien, Frankreich, Italien, Russland, Niederlande, Spanien, Schweden, Polen, Belgien, Schweiz, Dänemark, Norwegen, Finnland, Türkei, Restliches Europa |
|
Abgedeckte Marktteilnehmer |
USV Private Limited, Viatris Inc., Biocon, Fresenius Kabi AG, Hangzhou Jiuyuan Gene Engineering Co., Ltd., Amgen Inc., Pfizer Inc., Sandoz International GmbH, Apotex Inc., Cadila Pharmaceuticals, Dr. Reddy's Laboratories Ltd., Amneal Pharmaceuticals LLC., Coherus BioSciences, Accord Healthcare, NAPP PHARMACEUTICALS LIMITED., Intas Pharmaceuticals Ltd., Mundipharma International, Teva Pharmaceutical Industries Ltd., Spectrum Pharmaceuticals, Inc., Kyowa Kirin Co., Ltd., Jiangsu Hengrui Pharmaceuticals Co., Ltd. und andere. |
Europa G-CSF/ PEG-G-CSF Marktdefinition
Granulozyten-Kolonie-stimulierender Faktor (G-CSF) ist ein Medikament zur Behandlung von Neutropenie. Dies ist eine Krankheit, bei der die Anzahl der weißen Blutkörperchen unterdurchschnittlich ist und die durch einige Formen der Chemotherapie verursacht wird. Die wichtigsten G-CSF-Typen sind Lenograstim (Granocyte), Filgrastim (Neupogen, Zarzio, Nivestim, Accofil), lang wirkendes (pegyliertes) Filgrastim (Pegfilgrastim, Neulasta, Pelmeg, Ziextenco) und Lipegfilgrastim (Lonquex). Lenograstim ist ein glykosyliertes rekombinantes Therapeutikum, das chemisch dem natürlich vorkommenden menschlichen Granulozyten-Kolonie-stimulierenden Faktor (G-CSF) ähnlich oder identisch ist. Zu den verschiedenen Produkten gehören Tabletten und Kapseln und sie behandeln Krebs, Blutkrankheiten, Wachstumshormonmangel sowie chronische und Autoimmunkrankheiten.
Europa G-CSF/ PEG-G-CSF Marktdynamik
In diesem Abschnitt geht es um das Verständnis der Markttreiber, Vorteile, Chancen, Einschränkungen und Herausforderungen. All dies wird im Folgenden ausführlich erläutert:
Treiber
- Steigende Fälle von Blutkrebs und Krebserkrankungen
Krebs ist ein allgemeiner Begriff für viele Krankheiten, die jeden Teil des Körpers befallen können. Andere Begriffe für Krebs sind bösartige Tumore und Neoplasma. Eines der Merkmale von Krebs ist die schnelle Bildung abnormaler Zellen, die über das normale Maß hinaus wachsen und in benachbarte Körperteile eindringen und sich auf andere Organe ausbreiten können; letzterer Prozess wird als Metastasierung bezeichnet. Ausgedehnte Metastasen sind die häufigste Todesursache bei Krebs.
Filgrastim ist ein Granulozytenkolonie-stimulierender Faktor (GCSF), der hilft, die Anzahl der Neutrophilen im Blut zu erhöhen. Filgrastim und Pegfilgrastim werden häufig verwendet, um die Anzahl der weißen Blutkörperchen nach einer Chemotherapie oder Strahlentherapie zu erhöhen.
Somit wird die steigende Zahl der Fälle von Blutkrebs und Krebserkrankungen den europäischen G-CSF-/PEG-G-CSF-Markt in den kommenden Jahren antreiben.
- Zunehmende Fälle von febriler Neutropenie
Febrile Neutropenie bezeichnet Fieber während einer signifikanten Neutropenie. Bei einem Patienten mit Neutropenie kann das Infektionsrisiko höher als üblich sein und auch die Schwere einer bestimmten Infektion kann höher sein. Febrile Neutropenie ist die häufigste lebensbedrohliche Komplikation einer Krebsbehandlung. Ihre Behandlung ist häufig ein onkologischer Notfall.
Febrile Neutropenie ist eine Neutropenie, die von Fieber begleitet wird. Neutropenie bezeichnet eine Abnahme der Konzentration von Neutrophilen im Blut. Neutrophile sind eine Art weißer Blutkörperchen, die als Teil des Immunsystems bei der Bekämpfung von Infektionen helfen. Die Infectious Diseases Society of America definiert Neutropenie als eine absolute Neutrophilenzahl (ANC) von weniger als 1500 Zellen/mm3. Das Risiko einer Infektion und von neutropenischem Fieber steigt bei schwerer Neutropenie, definiert als eine absolute Neutrophilenzahl (ANC) von weniger als 500 Zellen/mm3, dramatisch an. Fieber wird definiert als eine einmalige orale Temperatur von mindestens 101° Fahrenheit (38,3° Celsius) oder eine anhaltende Temperatur von mindestens 100,4° Fahrenheit (38,0° Celsius) für eine Stunde oder länger.
Die neuesten Richtlinien dreier internationaler Krebsorganisationen – der Europäischen Organisation für Krebsforschung und -behandlung, der Amerikanischen Gesellschaft für Klinische Onkologie und des US-amerikanischen Nationalen Krebsnetzwerks – stimmen darin überein, dass Filgrastim oder Pegfilgrastim prophylaktisch bei febriler Neutropenie mit Chemotherapie verabreicht werden soll. Das Risiko liegt bei > oder = 20 % oder wenn das Risiko 10–20 % beträgt und der Patient andere Risikofaktoren für febrile Neutropenie aufweist.
Somit wird die zunehmende Zahl an Fällen febriler Neutropenie den europäischen G-CSF-/PEG-G-CSF-Markt in den kommenden Jahren weiter ankurbeln.
Zurückhaltung
- Strenge staatliche Vorschriften
Pharmaunternehmen, die Biosimilars wie Filgrastim entwickeln, stehen bei der Zulassung ihrer Produkte vor einer großen Herausforderung. In jedem Land gibt es für alle Medikamente, Behandlungen, Impfstoffe und Medizinprodukte ein anderes Zulassungsverfahren. Diese Zulassungsverfahren sind jedoch schwer einzuhalten. Dies liegt an den verschiedenen Vorschriften und Nachweisen, die erforderlich sind, um die Wirksamkeit und Sicherheit des Produkts nachzuweisen.
Die regulatorischen Anforderungen der Europäischen Arzneimittel-Agentur gewährleisten für Biosimilars die gleichen hohen Qualitäts-, Sicherheits- und Wirksamkeitsstandards wie für Original-Biologika. Sie umfassen auch eine strenge Vergleichbarkeitsprüfung mit dem Referenzprodukt, werden jedoch von Regulierungsbehörden außerhalb der Europäischen Union (EU) nicht allgemein akzeptiert. Es ist zu beachten, dass in Indien zugelassene „ähnliche Biologika“, im Iran zugelassene „Biogenerika“, in Argentinien zugelassene „medicamento biológico similares“ und in Südafrika zugelassene Nicht-Original-Biologika möglicherweise nicht zugelassen worden wären, wenn sie den strengen Regulierungsprozessen unterzogen worden wären, die für die Zulassung von Biosimilars in der EU erforderlich sind.
Aufgrund dieser strengen staatlichen Vorschriften, die bei der Produktion und Herstellung von G-CSF/PEG-G-CSF durch die verschiedenen Regulierungsbehörden eingehalten werden müssen, wird das Marktwachstum des europäischen G-CSF-/PEG-G-CSF-Marktes behindert.
Gelegenheit
- Der Einsatz von Biosimilars trägt zur Senkung der Gesundheitskosten für Patienten bei
Biosimilars haben das Potenzial, das Gesundheitswesen grundlegend zu verändern, indem sie Patienten erschwinglichere, ebenso wirksame Behandlungen bieten und Ärzten mehr Behandlungsmöglichkeiten eröffnen. Die Entwicklung von Biosimilars erfordert strenge Analysen, um ihre Gleichwertigkeit mit dem Referenzprodukt nachzuweisen und sicherzustellen, dass keine klinisch bedeutsamen Unterschiede in ihrer Sicherheit, Wirksamkeit und Reinheit bestehen. Dadurch können Gesundheitssysteme langfristige Einsparungen in allgemeine Verbesserungen der Patientenversorgung umsetzen. Um einen florierenden Biosimilar-Markt zu schaffen und den Zugang der Patienten zu gewährleisten, können politische Entscheidungsträger Schritte unternehmen, um die Kosten für Biosimilars zu senken oder zu eliminieren und Ärzte im Vergleich zu Europa dazu zu ermutigen, Biosimilars zu verschreiben.
Biosimilars haben das Potenzial, die Behandlungsmöglichkeiten zu erweitern und die gesundheitliche Gerechtigkeit zu erhöhen. Gleichzeitig können sie einzelnen Patienten und Gesundheitssystemen Geld sparen. Durch gesetzgeberische und Lobbyarbeit sowie künftige Initiativen kann der Zugang zu diesen wirksamen Medikamenten erweitert werden und die Gesundheitsversorgung für Patienten, die sie benötigen, grundlegend verändern.
Somit trägt der Einsatz von Biosimilars dazu bei, die Gesundheitskosten für Patienten zu senken. Dieser Faktor schafft Chancen für Marktwachstum.
Herausforderung
- Zahlreiche Nebenwirkungen von G-CSF
Granulozytenkolonie-stimulierender Faktor (G-CSF) ist ein Medikament zur Behandlung von Neutropenie, einer Erkrankung, bei der bestimmte Formen der Chemotherapie eine unterdurchschnittliche Anzahl weißer Blutkörperchen verursachen. G-CSF ist ein Wachstumsfaktor, der das Knochenmark dazu veranlasst, mehr weiße Blutkörperchen zu produzieren, um das Infektionsrisiko nach bestimmten Krebsbehandlungen zu verringern. G-CSF hat jedoch zahlreiche Nebenwirkungen, wie Knochen- oder Muskelschmerzen, Blutergüsse, Zahnfleisch- oder Nasenbluten, Durchfall, Fieber, Atemnot und Blässe, Schmerzen im Mund, Rachen, Darm und After usw. Diese Nebenwirkungen können bei mehr als 10 von 100 Personen (mehr als 10 %) auftreten.
Einer Studie des NCBI zufolge leiden die meisten normalen Spender, die G-CSF erhalten, unter Nebenwirkungen, die jedoch von leichter bis mittelschwerer Natur sind. 90 % der Spender leiden unter Nebenwirkungen von G-CSF. Die am häufigsten festgestellten Nebenwirkungen sind Knochenschmerzen (83 %), Kopfschmerzen (39 %), Gliederschmerzen (23 %), Müdigkeit (14 %) sowie Übelkeit und Erbrechen (12 %), was voraussichtlich eine Herausforderung für das Marktwachstum darstellt.
Daher stellen die zunehmenden Nebenwirkungen von G-CSF eine Herausforderung für das Marktwachstum dar.
Auswirkungen von COVID-19 auf den europäischen G-CSF/PEG-G-CSF-Markt
Die COVID-19-Pandemie hatte einen eher positiven Einfluss auf den G-CSF/PEG-G-CSF-Markt. Die Pandemie hat neue Normen und Vorschriften wie soziale Distanzierung und Ausgangssperren eingeführt, um die Ausbreitung des Virus zu verhindern. Infolgedessen waren die Menschen auf der ganzen Welt gezwungen, zu Hause zu bleiben, was zu neuen Trends wie der Arbeit zu Hause führte. Dieses Zuhausebleiben hat zu einem Rückgang der Diagnose und Prognose von Krankheiten geführt. Der verstärkte Fokus auf Selbstpflege, Bewegung und Gesundheit hat Fitness-Apps und -Plattformen im Zuge der Pandemie zu deutlichem Aufschwung verholfen.
Die Hersteller treffen verschiedene strategische Entscheidungen, um nach COVID-19 wieder auf die Beine zu kommen. Die Akteure führen zahlreiche F&E-Aktivitäten und Produktanläufe durch und gehen strategische Partnerschaften ein, um die Technologie und Testergebnisse auf dem Markt für Transplantationsdiagnostik zu verbessern.
Jüngste Entwicklungen
- Im Juli 2018 brachte Accord Healthcare, eine Tochtergesellschaft von Intas Pharmaceuticals Ltd., ein Pegfilgrastim-Biosimilar in ganz Europa auf den Markt, nachdem der CHMP (Ausschuss für Humanarzneimittel) grünes Licht für Pelgraz® (Pegfilgrastim) gegeben hatte. Die Markteinführung dieses Produkts half dem Unternehmen, sein Geschäft in ganz Europa auszuweiten.
- Im März 2022 gab Kashiv Biosciences die Genehmigung seines Biologics License Application (BLA) für Filgrastim-ayow, ein Biosimilar mit Bezug auf Neupogen, durch die US-amerikanische Food and Drug Administration (FDA) bekannt. Das Produkt wird unter dem Markennamen RELEUKO vermarktet.
Europa G-CSF/ PEG-G-CSF Marktumfang
Der europäische G-CSF/PEG-G-CSF-Markt ist segmentiert nach Indikation, Dosierung, Verabreichungsweg, Verpackung, Endverbraucher und Vertriebskanal. Das Wachstum zwischen den Segmenten hilft Ihnen, Nischenwachstumsbereiche und Strategien zur Marktbearbeitung zu analysieren und Ihre Kernanwendungsbereiche und die Unterschiede in Ihren Zielmärkten zu bestimmen.
EUROPA G-CSF / PEG-G-CSF-MARKT, NACH INDIKATION
- NEUTROPENIE
- Durch Chemotherapie induzierte febrile Neutropenie (myelosuppressive Chemotherapie-Behandlung)
- SCHWERE CHRONISCHE NEUTROPENIE
- Durch Strahlentherapie induzierte Neutropenie
- NEUTROPENIE BEI HIV-PATIENTEN
- Clozapin-induzierte Neutropenie
- NEUTROPENIE BEI HEPATITIS C-PATIENTEN
- Angeborene Neutropenie
- ONKOLOGIE
- Akute myeloide Leukämie mit Konsolidierungschemotherapie
- ANDERE
- CHRONISCHE UND AUTOIMMUNERKRANKUNGEN
- Blutkrankheiten
- WACHSTUMSHORMONENMangel
- ANDERE
Auf Grundlage der Indikation wird G-CSF/PEG-G-CSF in Europa weiter segmentiert in Neutropenie, Onkologie, chronische und Autoimmunerkrankungen, Blutkrankheiten, Wachstumshormonmangel und Sonstiges.
EUROPA G-CSF / PEG-G-CSF-MARKT, NACH DOSIERUNG
- MONO
- KOMBINATION
Auf Grundlage der Dosierung wird G-CSF/PEG-G-CSF in Europa weiter in Mono- und Kombinationspräparate unterteilt.
EUROPÄISCHER G-CSF-/PEG-G-CSF-MARKT, NACH ANWENDUNGSART
- INTRAVENÖS
- SUBKUTAN
Auf Grundlage der Verabreichungsart wird G-CSF/PEG-G-CSF in Europa weiter in intravenöse und subkutane Verabreichung unterteilt.
EUROPA G-CSF / PEG-G-CSF-MARKT, NACH VERPACKUNG
- EINMALVERWENDUNGSFLASCHEN
- FERTIGSPRITZEN
Auf Grundlage der Verpackung wird G-CSF/PEG-G-CSF in Europa weiter in Durchstechflaschen zur Einmalverwendung und vorgefüllte Spritzen unterteilt.
EUROPA G-CSF / PEG-G-CSF-MARKT, NACH ENDVERBRAUCHER
- KRANKENHÄUSER & KLINIKEN
- FORSCHUNG & AKADEMISCHE INSTITUTE
- AMBULANTE CHIRURGISCHE ZENTREN
- ANDERE
Auf der Grundlage des Endbenutzers wird G-CSF/PEG-G-CSF in Europa weiter in Krankenhäuser und Kliniken, Forschungs- und akademische Institute, ambulante chirurgische Zentren und andere unterteilt.
EUROPÄISCHER G-CSF-/PEG-G-CSF-MARKT, NACH VERTRIEBSKANAL
- KRANKENHAUSAPOTHEKE
- ONLINE-APOTHEKE
- EINZELHANDELSAPOTHEKE
- ANDERE
On the basis of distribution channel the Europe G-CSF/PEG-G-CSF is further segmented into hospital pharmacy, online pharmacy, retail pharmacy and others.
Europe G-CSF/ PEG-G-CSF Market Regional Analysis/Insights
The Europe G-CSF/ PEG-G-CSF market is analyzed and market size information is provided based on country, indication, dosage, route of administration, packaging, end user, and distribution channel.
The Europe G-CSF/ PEG-G-CSF market comprises od the countries Germany, U.K., France, Italy, Russia, Netherlands, Spain, Sweden, Poland, Belgium, Switzerland, Denmark, Norway, Finland, Turkey, Rest of Europe.
Germany is expected to grow due to its latest advanced technology and inventions in the G-CSF/ PEG-G-CSF.
The country section of the report also provides individual market impacting factors and changes in regulation in the market domestically that impact the current and future trends of the market. Data points such as new sales, replacement sales, country demographics, regulatory acts, and import-export tariffs are some of the major pointers used to forecast the market scenario for individual countries. Also, presence and availability of Europe brands and their challenges faced due to large or scarce competition from local and domestic brands, and impact of sales channels are considered while providing forecast analysis of the country data.
Competitive Landscape and Europe G-CSF/ PEG-G-CSF Market Share Analysis
Europe G-CSF/ PEG-G-CSF market competitive landscape provides details by competitor. Details included are company overview, company financials, revenue generated, market potential, investment in R&D, new market initiatives, production sites and facilities, company strengths and weaknesses, product launch, product trials pipelines, product approvals, patents, product width and breath, application dominance, technology lifeline curve. The above data points provided are only related to the company’s focus on the Europe G-CSF/ PEG-G-CSF market.
Some major companies which are dealing in the market are USV Private Limited, Viatris Inc., Biocon, Fresenius Kabi AG, Hangzhou Jiuyuan Gene Engineering Co., Ltd., Amgen Inc., Pfizer Inc., Sandoz International GmbH, Apotex Inc., Cadila Pharmaceuticals, Dr. Reddy’s Laboratories Ltd., Amneal Pharmaceuticals LLC., Coherus BioSciences, Accord Healthcare, NAPP PHARMACEUTICALS LIMITED., Intas Pharmaceuticals Ltd., Mundipharma International, Teva Pharmaceutical Industries Ltd., Spectrum Pharmaceuticals, Inc., Kyowa Kirin Co., Ltd., Jiangsu Hengrui Pharmaceuticals Co., Ltd., among others.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Inhaltsverzeichnis
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF EUROPE G-CSF / PEG-G-CSF MARKET
1.4 LIMITATIONS
1.5 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 MARKETS COVERED
2.2 GEOGRAPHICAL SCOPE
2.3 YEARS CONSIDERED FOR THE STUDY
2.4 CURRENCY AND PRICING
2.5 DBMR TRIPOD DATA VALIDATION MODEL
2.6 MULTIVARIATE MODELLING
2.7 TYPE LIFELINE CURVE
2.8 PRIMARY INTERVIEWS WITH KEY OPINION LEADERS
2.9 DBMR MARKET POSITION GRID
2.1 MARKET END USER COVERAGE GRID
2.11 VENDOR SHARE ANALYSIS
2.12 SECONDARY SOURCES
2.13 ASSUMPTIONS
3 EXECUTIVE SUMMARY
4 PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTER’S FIVE FORCES
4.3 EUROPE G-CSF/PEG-G-CSF MARKET: MERGERS AND ACQUISITION
4.4 EUROPE G-CSF / PEG-G-CSF MARKET
4.5 STRATEGIES TO THE ENTER THE MARKET
4.5.1 JOINT VENTURE (PARTNERSHIPS):
4.5.2 ACQUISITION:
4.5.3 LINE EXPANSION VIA COLLABORATION:
4.5.4 PRODUCT APPROVAL:
4.5.5 PRODUCT LAUNCH:
4.5.6 GEOGRAPHIC EXPANSION:
4.5.7 COST LEADERSHIP:
4.5.8 PRODUCT DEVELOPMENT:
4.6 EUROPE G-CSF / PEG-G-CSF MARKET, INDUSTRY INSIGHTS
4.6.1 PATENT ANALYSIS
4.6.2 DRUG TREATMENT RATE BY MATURED MARKETS
4.6.3 DEMOGRAPHIC TRENDS: IMPACTS ON ALL INCIDENCE RATES
4.6.4 THERAPEUTIC ASSESSMENT
4.6.5 KEY PRICING STRATEGIES
4.6.6 KEY PATIENT ENROLLMENT STRATEGIES
4.6.7 CONCLUSION
4.7 PIPELINE ANALYSIS FOR EUROPE G-CSF / PEG-G-CSF MARKET
5 EPIDEMIOLOGY
6 EUROPE G-CSF / PEG-G-CSF MARKET: REGULATIONS
7 MARKET OVERVIEW
7.1 DRIVERS
7.1.1 GROWING INCIDENCES OF BLOOD CANCERS AND CANCER DISEASES
7.1.2 RISING INCIDENCES OF AUTOIMMUNE DISORDERS
7.1.3 INCREASING CASES OF FEBRILE NEUTROPENIA
7.1.4 INCREASING AWARENESS ABOUT FILGRASTIM AND PEGFILGRASTIM
7.2 RESTRAIN
7.2.1 STRINGENT GOVERNMENTAL REGULATIONS
7.2.2 AVAILABILITY OF ALTERNATIVES FOR THE CHEMOTHERAPY
7.3 OPPORTUNITIES
7.3.1 THE USE OF BIOSIMILARS HELPS REDUCE HEALTHCARE COSTS FOR PATIENTS
7.3.2 COST-EFFECTIVENESS AND PATENT EXPIRY OF BIOLOGICAL PRODUCTS
7.4 CHALLENGES
7.4.1 THE HIGH COST ASSOCIATED WITH BRANDED BIOLOGICS AND IMPROVED CHEMOTHERAPY
7.4.2 THE MULTIPLE SIDE EFFECTS OF G-CSF
8 EUROPE G-CSF/ PEG-G-CSF MARKET, BY INDICATION
8.1 OVERVIEW
8.2 NEUTROPENIA
8.2.1 CHEMOTHERAPY INDUCED FEBRILE NEUTROPENIA (MYELOSUPPRESSIVE CHEMOTHERAPY TREATMENT)
8.2.2 SEVERE CHRONIC NEUTROPENIA
8.2.3 RADIOTHERAPY INDUCED NEUTROPENIA
8.2.4 NEUTROPENIA IN HIV PATIENTS
8.2.5 CLOZAPINE INDUCED NEUTROPENIA
8.2.6 NEUTROPENIA IN HEPATITIS C PATIENTS
8.2.7 CONGENITAL NEUTROPENIA
8.3 ONCOLOGY
8.3.1 ACUTE MYELOID LEUKEMIA RECEIVING CONSOLIDATION CHEMOTHERAPY
8.3.2 OTHERS
8.4 CHRONIC AND AUTO IMMUNE DISEASES
8.5 BLOOD DISORDERS
8.6 GROWTH HORMONE DEFICIENCY
8.7 OTHERS
9 EUROPE G-CSF/ PEG-G-CSF MARKET, BY DOSAGE
9.1 OVERVIEW
9.2 MONO
9.3 COMBINATION
10 EUROPE G-CSF/ PEG-G-CSF MARKET, BY ROUTE OF ADMINISTRATION
10.1 OVERVIEW
10.2 SUBCUTANEOUS
10.3 INTRAVENOUS
11 EUROPE G-CSF/ PEG-G-CSF MARKET, BY PACKAGING
11.1 OVERVIEW
11.2 PRE FILLED SYRINGES
11.3 SINGLE USE VIALS
12 EUROPE G-CSF/ PEG-G-CSF MARKET, BY END USER
12.1 OVERVIEW
12.2 HOSPITALS AND CLINICS
12.3 RESEARCH & ACADEMIC INSTITUTES
12.4 AMBULATORY SURGICAL CENTERS
12.5 OTHERS
13 EUROPE G-CSF/ PEG-G-CSF MARKET, BY DISTRIBUTION CHANNEL
13.1 OVERVIEW
13.2 HOSPITALS PHARMACY
13.3 RETAIL PHARMACY
13.4 ONLINE PHARMACY
13.5 OTHERS
14 EUROPE G-CSF/PEG-G-CSF MARKET, BY REGION
14.1 EUROPE
14.1.1 RUSSIA
14.1.2 TURKEY
15 EUROPE G-CSF / PEG-G-CSF MARKET, COMPANY LANDSCAPE
15.1 COMPANY SHARE ANALYSIS: EUROPE
16 SWOT ANALYSIS
17 COMPANY PROFILE
17.1 PFIZER INC.
17.1.1 COMPANY SNAPSHOT
17.1.2 REVENUE ANALYSIS
17.1.3 COMPANY SHARE ANALYSIS
17.1.4 PRODUCT PORTFOLIO
17.1.5 RECENT DEVELOPMENTS
17.2 VIATRIS INC.
17.2.1 COMPANY SNAPSHOT
17.2.2 REVENUE ANALYSIS
17.2.3 COMPANY SHARE ANALYSIS
17.2.4 PRODUCT PORTFOLIO
17.2.5 RECENT DEVELOPMENT
17.3 AMGEN INC.
17.3.1 COMPANY SNAPSHOT
17.3.2 REVENUE ANALYSIS
17.3.3 COMPANY SHARE ANALYSIS
17.3.4 PRODUCT PORTFOLIO
17.3.5 RECENT DEVELOPMENTS
17.4 STADA ARZENEIMITTEL AG
17.4.1 COMPANY SNAPSHOT
17.4.2 COMPANY SHARE ANALYSIS
17.4.3 PRODUCT PORTFOLIO
17.4.4 RECENT DEVELOPMENT
17.5 TEVA PHARMACEUTICAL INDUSTRIES LTD.
17.5.1 COMPANY SNAPSHOT
17.5.2 REVENUE ANALYSIS
17.5.3 COMPANY SHARE ANALYSIS
17.5.4 PRODUCT PORTFOLIO
17.5.5 RECENT DEVELOPMENTS
17.6 JIANGSU HENGRUI PHARMACEUTICALS CO., LTD.
17.6.1 COMPANY SNAPSHOT
17.6.2 PRODUCT PORTFOLIO
17.6.3 RECENT DEVELOPMENTS
17.7 ACCORD HEALTHCARE
17.7.1 COMPANY SNAPSHOT
17.7.2 PRODUCT PORTFOLIO
17.7.3 RECENT DEVELOPMENTS
17.8 AMNEAL PHARMACEUTICALS LLC.
17.8.1 COMPANY SNAPSHOT
17.8.2 REVENUE ANALYSIS
17.8.3 PRODUCT PORTFOLIO
17.8.4 RECENT DEVELOPMENTS
17.9 APOTEX INC.
17.9.1 COMPANY SNAPSHOT
17.9.2 PRODUCT PORTFOLIO
17.9.3 RECENT DEVELOPMENT
17.1 BIOCON
17.10.1 COMPANY SNAPSHOT
17.10.2 REVENUE ANALYSIS
17.10.3 PRODUCT PORTFOLIO
17.10.4 RECENT DEVELOPMENT
17.11 BIO SIDUS
17.11.1 COMPANY SNAPSHOT
17.11.2 PRODUCT PORTFOLIO
17.11.3 RECENT DEVELOPMENTS
17.12 CADILA PHARMACEUTICALS
17.12.1 COMPANY SNAPSHOT
17.12.2 PRODUCT PORTFOLIO
17.12.3 RECENT DEVELOPMENTS
17.13 COHERUS BIOSCIENCES
17.13.1 COMPANY SNAPSHOT
17.13.2 REVENUE ANALYSIS
17.13.3 PRODUCT PORTFOLIO
17.13.4 RECENT DEVELOPMENT
17.14 DR. REDDY’S LABORATORIES LTD
17.14.1 COMPANY SNAPSHOT
17.14.2 REVENUE ANALYSIS
17.14.3 PRODUCT PORTFOLIO
17.14.4 RECENT DEVELOPMENTS
17.15 FRESENIUS KABI AG
17.15.1 COMPANY SNAPSHOT
17.15.2 PRODUCT PORTFOLIO
17.15.3 RECENT DEVELOPMENT
17.16 GENNOVA BIOPHARMACEUTICALS LIMITED
17.16.1 COMPANY SNAPSHOT
17.16.2 PRODUCT PORTFOLIO
17.16.3 RECENT DEVELOPMENTS
17.17 HANGZHOU JIUYUAN GENE ENGINEERING CO., LTD.
17.17.1 COMPANY SNAPSHOT
17.17.2 PRODUCT PORTFOLIO
17.17.3 RECENT DEVELOPMENTS
17.18 INTAS PHARMACEUTICALS LTD.
17.18.1 COMPANY SNAPSHOT
17.18.2 PRODUCT PORTFOLIO
17.18.3 RECENT DEVELOPMENT
17.19 KASHIV BIOSCIENCES, LLC.
17.19.1 COMPANY SNAPSHOT
17.19.2 PRODUCT PORTFOLIO
17.19.3 RECENT DEVELOPMENT
17.2 KYOWA KIRIN CO., LTD.
17.20.1 COMPANY SNAPSHOT
17.20.2 REVENUE ANALYSIS
17.20.3 PRODUCT PORTFOLIO
17.20.4 RECENT DEVELOPMENT
17.21 LUPIN
17.21.1 COMPANY SNAPSHOT
17.21.2 REVENUE ANALYSIS
17.21.3 PRODUCT PORTFOLIO
17.21.4 RECENT DEVELOPMENT
17.22 MUNDIPHARMA INTERNATIONAL.
17.22.1 COMPANY SNAPSHOT
17.22.2 PRODUCT PORTFOLIO
17.22.3 RECENT DEVELOPMENT
17.23 NAPP PHARMACEUTICALS LIMITED
17.23.1 COMPANY SNAPSHOT
17.23.2 PRODUCT PORTFOLIO
17.23.3 RECENT DEVELOPMENT
17.24 RELIANCE LIFE SCIENCES
17.24.1 COMPANY SNAPSHOT
17.24.2 PRODUCT PORTFOLIO
17.24.3 RECENT DEVELOPMENTS
17.25 SANDOZ INTERNATIONAL GMBH
17.25.1 COMPANY SNAPSHOT
17.25.2 REVENUE ANALYSIS
17.25.3 PRODUCT PORTFOLIO
17.25.4 RECENT DEVELOPMENTS
17.26 SPECTRUM PHARMACEUTICALS, INC.
17.26.1 COMPANY SNAPSHOT
17.26.2 PRODUCT PORTFOLIO
17.26.3 RECENT DEVELOPMENT
17.27 USV PRIVATE LIMITED
17.27.1 COMPANY SNAPSHOT
17.27.2 PRODUCT PORTFOLIO
17.27.3 RECENT DEVELOPMENTS
18 QUESTIONNAIRE
19 RELATED REPORTS
Tabellenverzeichnis
TABLE 1 BELOW ARE THE RULES AND REGULATIONS TO GET APPROVAL FOR USE IN THE MARKET:
TABLE 2 EUROPE G-CSF/ PEG-G-CSF MARKET, BY INDICATION, 2021-2030 (USD MILLION)
TABLE 3 EUROPE NEUTROPENIA IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 4 EUROPE NEUTROPENIA IN G-CSF/ PEG-G-CSF MARKET, BY INDICATION, 2021-2030 (USD MILLION)
TABLE 5 EUROPE ONCOLOGY IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 6 EUROPE ONCOLOGY IN G-CSF/ PEG-G-CSF MARKET, BY INDICATION, 2021-2030 (USD MILLION)
TABLE 7 EUROPE CHRONIC AND AUTO IMMUNE DISEASES IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 8 EUROPE BLOOD DISORDERS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 9 EUROPE GROWTH HORMONE DEFICIENCY IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 10 EUROPE OTHERS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 11 EUROPE G-CSF/ PEG-G-CSF MARKET, BY DOSAGE, 2020-2029 (USD MILLION)
TABLE 12 EUROPE MONO IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 13 EUROPE COMBINATION IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 14 EUROPE G-CSF/ PEG-G-CSF MARKET, BY ROUTE OF ADMINISTRATION, 2020-2029 (USD MILLION)
TABLE 15 EUROPE SUBCUTANEOUS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 16 EUROPE INTRAVENOUS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 17 EUROPE G-CSF/ PEG-G-CSF MARKET, BY PACKAGING, 2020-2029 (USD MILLION)
TABLE 18 EUROPE PRE FILLED SYRINGES IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 19 EUROPE SINGLE USE VIALS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 20 EUROPE G-CSF/ PEG-G-CSF MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 21 EUROPE HOSPITALS AND CLINICS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 22 EUROPE RESEARCH & ACADEMIC INSTITUTES IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 23 EUROPE AMBULATORY SURGICAL CENTERS IN G-CSF/ PEG-G-CSFMARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 24 EUROPE OTHERS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 25 EUROPE G-CSF/ PEG-G-CSF MARKET, BY DISTRIBUTION CHANNEL, 2020-2029 (USD MILLION)
TABLE 26 EUROPE HOSPITALS PHARMACY IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 27 EUROPE RETAIL PHARMACY IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 28 EUROPE ONLINE PHARMACY IN G-CSF/ PEG-G-CSFMARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 29 EUROPE OTHERS IN G-CSF/ PEG-G-CSF MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 30 EUROPE G-CSF / PEG-G-CSF MARKET, 2020-2030 (USD MILLION)
TABLE 31 EUROPE G-CSF / PEG-G-CSF MARKET, BY COUNTRY, 2020-2030 (USD MILLION)
TABLE 32 EUROPE G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 33 EUROPE NEUTROPENIA IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 34 EUROPE ONCOLOGY IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 35 EUROPE G-CSF / PEG-G-CSF MARKET, BY DOSAGE, 2020-2030 (USD MILLION)
TABLE 36 EUROPE G-CSF / PEG-G-CSF MARKET, BY ROUTE OF ADMINISTRATION, 2020-2030 (USD MILLION)
TABLE 37 EUROPE G-CSF / PEG-G-CSF MARKET, BY PACKAGING, 2020-2030 (USD MILLION)
TABLE 38 EUROPE G-CSF / PEG-G-CSF MARKET, BY END USER, 2020-2030 (USD MILLION)
TABLE 39 EUROPE G-CSF / PEG-G-CSF MARKET, BY DISTRIBUTION CHANNEL, 2020-2030 (USD MILLION)
TABLE 40 RUSSIA G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 41 RUSSIA NEUTROPENIA IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 42 RUSSIA ONCOLOGY IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 43 RUSSIA G-CSF / PEG-G-CSF MARKET, BY DOSAGE, 2020-2030 (USD MILLION)
TABLE 44 RUSSIA MONO IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 45 RUSSIA G-CSF / PEG-G-CSF MARKET, BY ROUTE OF ADMINISTRATION, 2020-2030 (USD MILLION)
TABLE 46 RUSSIA SUBCUTANEOUS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 47 RUSSIA G-CSF / PEG-G-CSF MARKET, BY PACKAGING, 2020-2030 (USD MILLION)
TABLE 48 RUSSIA PRE FILLED SYRINGES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 49 RUSSIA G-CSF / PEG-G-CSF MARKET, BY END USER, 2020-2030 (USD MILLION)
TABLE 50 RUSSIA HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 51 RUSSIA HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 52 RUSSIA HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 53 RUSSIA RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 54 RUSSIA RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 55 RUSSIA RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 56 RUSSIA AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 57 RUSSIA AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 58 RUSSIA AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 59 RUSSIA G-CSF / PEG-G-CSF MARKET, BY DISTRIBUTION CHANNEL, 2020-2030 (USD MILLION)
TABLE 60 RUSSIA HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 61 RUSSIA HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 62 RUSSIA HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 63 RUSSIA RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 64 RUSSIA RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 65 RUSSIA RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 66 RUSSIA ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 67 RUSSIA ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 68 RUSSIA ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 69 TURKEY G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 70 TURKEY NEUTROPENIA IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 71 TURKEY ONCOLOGY IN G-CSF / PEG-G-CSF MARKET, BY INDICATION, 2020-2030 (USD MILLION)
TABLE 72 TURKEY G-CSF / PEG-G-CSF MARKET, BY DOSAGE, 2020-2030 (USD MILLION)
TABLE 73 TURKEY MONO IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 74 TURKEY G-CSF / PEG-G-CSF MARKET, BY ROUTE OF ADMINISTRATION, 2020-2030 (USD MILLION)
TABLE 75 TURKEY SUBCUTANEOUS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 76 TURKEY INTRAVENOUS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 77 TURKEY G-CSF / PEG-G-CSF MARKET, BY PACKAGING, 2020-2030 (USD MILLION)
TABLE 78 TURKEY PRE FILLED SYRINGES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 79 TURKEY SINGLE USE VIALS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 80 TURKEY G-CSF / PEG-G-CSF MARKET, BY END USER, 2020-2030 (USD MILLION)
TABLE 81 TURKEY HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 82 TURKEY HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 83 TURKEY HOSPITAL AND CLINICS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 84 TURKEY RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 85 TURKEY RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 86 TURKEY RESEARCH AND ACADEMIC INSTITUTES IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 87 TURKEY AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 88 TURKEY AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 89 TURKEY AMBULATORY SURGICAL CENTERS IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 90 TURKEY G-CSF / PEG-G-CSF MARKET, BY DISTRIBUTION CHANNEL, 2020-2030 (USD MILLION)
TABLE 91 TURKEY HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 92 TURKEY HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 93 TURKEY HOSPITAL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 94 TURKEY RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 95 TURKEY RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 96 TURKEY RETAIL PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
TABLE 97 TURKEY ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 (USD MILLION)
TABLE 98 TURKEY ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 ASP (USD)
TABLE 99 TURKEY ONLINE PHARMACY IN G-CSF / PEG-G-CSF MARKET, BY BRAND, 2020-2030 VOLUME (UNITS)
Abbildungsverzeichnis
FIGURE 1 EUROPE G-CSF / PEG-G-CSF MARKET: SEGMENTATION
FIGURE 2 EUROPE G-CSF / PEG-G-CSF MARKET: DATA TRIANGULATION
FIGURE 3 EUROPE G-CSF / PEG-G-CSF MARKET: DROC ANALYSIS
FIGURE 4 EUROPE G-CSF / PEG-G-CSF MARKET: EUROPE VS REGIONAL MARKET ANALYSIS
FIGURE 5 EUROPE G-CSF / PEG-G-CSF MARKET: COMPANY RESEARCH ANALYSIS
FIGURE 6 EUROPE G-CSF / PEG-G-CSF MARKET: INTERVIEW DEMOGRAPHICS
FIGURE 7 EUROPE G-CSF / PEG-G-CSF MARKET: DBMR MARKET POSITION GRID
FIGURE 8 EUROPE G-CSF / PEG-G-CSF MARKET: MARKET END USER COVERAGE GRID
FIGURE 9 EUROPE G-CSF / PEG-G-CSF MARKET: VENDOR SHARE ANALYSIS
FIGURE 10 EUROPE G-CSF / PEG-G-CSF MARKET: SEGMENTATION
FIGURE 11 THE INCREASE IN CANCER PROPHYLAXIS IN DEVELOPED COUNTRIES AND INITIATIVES TAKEN BY GOVERNMENTS ARE TO DRIVE THE EUROPE G-CSF / PEG-G-CSF MARKET FROM 2023 TO 2030
FIGURE 12 NEUTROPENIA SEGMENT IS EXPECTED TO ACCOUNT FOR THE LARGEST SHARE OF THE EUROPE G-CSF / PEG-G-CSF MARKET IN 2023 & 2030
FIGURE 13 DRIVERS, RESTRAINTS, OPPORTUNITIES, AND CHALLENGES OF THE EUROPE G-CSF / PEG-G-CSF MARKET
FIGURE 14 EUROPE G-CSF/ PEG-G-CSF MARKET: BY INDICATION CATEGORY, 2022
FIGURE 15 EUROPE G-CSF/ PEG-G-CSF MARKET: BY INDICATION CATEGORY, 2021-2030 (USD MILLION)
FIGURE 16 EUROPE G-CSF/ PEG-G-CSF MARKET: BY INDICATION CATEGORY, CAGR (2022-2029)
FIGURE 17 EUROPE G-CSF/ PEG-G-CSF MARKET: BY INDICATION CATEGORY, LIFELINE CURVE
FIGURE 18 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DOSAGE, 2022
FIGURE 19 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DOSAGE, 2021-2030 (USD MILLION)
FIGURE 20 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DOSAGE, CAGR (2023-2030)
FIGURE 21 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DOSAGE, LIFELINE CURVE
FIGURE 22 EUROPE G-CSF/ PEG-G-CSF MARKET: BY ROUTE OF ADMINISTRATION, 2022
FIGURE 23 EUROPE G-CSF/ PEG-G-CSF MARKET: BY ROUTE OF ADMINISTRATION, 2021-2030 (USD MILLION)
FIGURE 24 EUROPE G-CSF/ PEG-G-CSF MARKET: BY ROUTE OF ADMINISTRATION, CAGR (2023-2030)
FIGURE 25 EUROPE G-CSF/ PEG-G-CSF MARKET: BY ROUTE OF ADMINISTRATION, LIFELINE CURVE
FIGURE 26 EUROPE G-CSF/ PEG-G-CSF MARKET: BY PACKAGING, 2022
FIGURE 27 EUROPE G-CSF/ PEG-G-CSF MARKET: BY PACKAGING, 2021-2030 (USD MILLION)
FIGURE 28 EUROPE G-CSF/ PEG-G-CSF MARKET: BY PACKAGING, CAGR (2023-2030)
FIGURE 29 EUROPE G-CSF/ PEG-G-CSF MARKET: BY PACKAGING, LIFELINE CURVE
FIGURE 30 EUROPE G-CSF/ PEG-G-CSF MARKET: BY END USER, 2022
FIGURE 31 EUROPE G-CSF/ PEG-G-CSF MARKET: BY END USER, 2021-2030 (USD MILLION)
FIGURE 32 EUROPE G-CSF/ PEG-G-CSF MARKET: BY END USER, CAGR (2023-2030)
FIGURE 33 EUROPE G-CSF/ PEG-G-CSF MARKET: BY END USER, LIFELINE CURVE
FIGURE 34 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DISTRIBUTION CHANNEL, 2022
FIGURE 35 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DISTRIBUTION CHANNEL, 2021-2030 (USD MILLION)
FIGURE 36 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DISTRIBUTION CHANNEL, CAGR (2023-2030)
FIGURE 37 EUROPE G-CSF/ PEG-G-CSF MARKET: BY DISTRIBUTION CHANNEL, LIFELINE CURVE
FIGURE 38 EUROPE G-CSF/PEG-G-CSF MARKET: SNAPSHOT (2022)
FIGURE 39 EUROPE G-CSF/PEG-G-CSF MARKET: BY COUNTRY (2022)
FIGURE 40 EUROPE G-CSF/PEG-G-CSF MARKET: BY COUNTRY (2022 & 2030)
FIGURE 41 EUROPE G-CSF/PEG-G-CSF MARKET: BY COUNTRY (2022 & 2030)
FIGURE 42 EUROPE G-CSF/PEG-G-CSF MARKET: BY INDICATION (2023-2030)
FIGURE 43 EUROPE G-CSF / PEG-G-CSF MARKET: COMPANY SHARE 2022 (%)
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.