Europe Electronic Clinical Outcome Assessment Ecoa Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
1.92 Billion
USD
6.42 Billion
2024
2032
USD
1.92 Billion
USD
6.42 Billion
2024
2032
| 2025 –2032 | |
| USD 1.92 Billion | |
| USD 6.42 Billion | |
|
|
|
|
Marktsegmentierung für elektronische klinische Ergebnisbeurteilungen (eCOA) in Europa nach Produkt (On-Premise-Lösungen, Cloud-basierte Lösungen und webbasierte Lösungen), Ansatz (Clinician Reported Outcome Assessment (CLINRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (OBSRO) und Performance Outcome Assessment (PERFO)), Endbenutzer (kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen), Plattform (Auftragsforschungsinstitute, Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsdienstleister, Forschung und Wissenschaft und andere) – Branchentrends und Prognose bis 2032
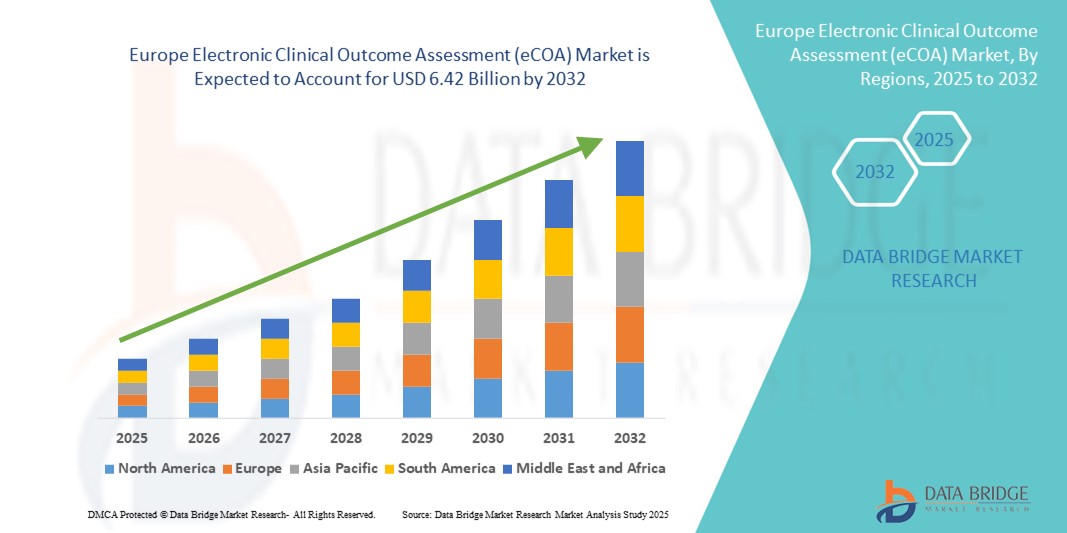
Marktgröße für elektronische klinische Ergebnisbewertung (eCOA) in Europa
- Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) hatte im Jahr 2024 ein Volumen von 1,92 Milliarden US-Dollar und dürfte bis 2032 6,42 Milliarden US-Dollar erreichen , bei einer CAGR von 16,30 % im Prognosezeitraum.
- Das Marktwachstum wird maßgeblich durch die zunehmende Nutzung digitaler Gesundheitslösungen, die Modernisierung klinischer Studien und die regulatorische Unterstützung der elektronischen Datenerfassung vorangetrieben, wodurch effizientere und genauere patientenberichtete Ergebnisse ermöglicht werden.
- Darüber hinaus macht die steigende Nachfrage von Pharma- und Biotechnologieunternehmen nach patientenorientierter Datenerfassung und -analyse in Echtzeit eCOA-Lösungen zu einem wesentlichen Bestandteil der klinischen Forschung. Diese konvergierenden Faktoren beschleunigen die Einführung von eCOA-Plattformen und fördern damit das Wachstum der Branche erheblich.
Marktanalyse für elektronische klinische Ergebnisbewertung (eCOA) in Europa
- eCOA-Lösungen, die die elektronische Erfassung von patienten-, klinik- und beobachterberichteten Ergebnissen ermöglichen, werden zu unverzichtbaren Instrumenten in klinischen Studien in ganz Europa, da sie die Datengenauigkeit, die Echtzeitüberwachung und die Patienteneinbindung verbessern können.
- Die zunehmende Verbreitung von eCOA-Plattformen ist vor allem auf die zunehmende Digitalisierung klinischer Studien, die Notwendigkeit einer patientenzentrierten Datenerfassung und die regulatorische Förderung der elektronischen Datenerfassung zur Gewährleistung der Compliance und zur Reduzierung von Fehlern zurückzuführen.
- Deutschland dominierte den europäischen Markt für elektronische klinische Ergebnisbewertungen (eCOA) mit dem größten Umsatzanteil von 42,8 % im Jahr 2024, unterstützt durch eine starke Pharma- und Biotechnologieindustrie, eine fortschrittliche Gesundheitsinfrastruktur und die frühzeitige Einführung digitaler Testtechnologien, wobei lokale und multinationale Unternehmen aktiv eCOA-Lösungen implementierten.
- Großbritannien dürfte im Prognosezeitraum das am schnellsten wachsende Land auf dem europäischen Markt für elektronische klinische Ergebnisbewertungen (eCOA) sein. Dies ist auf die hohe Anzahl laufender klinischer Studien, die fortschreitende Einführung digitaler Gesundheitstools und steigende Investitionen in patientenzentrierte Forschungsplattformen zurückzuführen.
- Das Segment der patientenberichteten Ergebnisse (PRO) dominierte den europäischen Markt für elektronische klinische Ergebnisbewertungen (eCOA) mit einem Marktanteil von 47 % im Jahr 2024, getrieben durch die zunehmende Betonung patientenzentrierter Studien, die einfache elektronische Datenerfassung und die verbesserte Möglichkeit, Patientenfeedback effizient in Echtzeit zu erfassen.
Berichtsumfang und Marktsegmentierung für elektronische klinische Ergebnisbewertung (eCOA) in Europa
|
Eigenschaften |
Wichtige Markteinblicke zur elektronischen klinischen Ergebnisbewertung (eCOA) in Europa |
|
Abgedeckte Segmente |
|
|
Abgedeckte Länder |
Europa
|
|
Wichtige Marktteilnehmer |
|
|
Marktchancen |
|
|
Wertschöpfungsdaten-Infosets |
Zusätzlich zu den Einblicken in Marktszenarien wie Marktwert, Wachstumsrate, Segmentierung, geografische Abdeckung und wichtige Akteure enthalten die von Data Bridge Market Research kuratierten Marktberichte auch ausführliche Expertenanalysen, Preisanalysen, Markenanteilsanalysen, Verbraucherumfragen, demografische Analysen, Lieferkettenanalysen, Wertschöpfungskettenanalysen, eine Übersicht über Rohstoffe/Verbrauchsmaterialien, Kriterien für die Lieferantenauswahl, PESTLE-Analysen, Porter-Analysen und regulatorische Rahmenbedingungen. |
Markttrends für elektronische klinische Ergebnisbeurteilung (eCOA) in Europa
Verbesserte Patientenzentrierung durch mobile und Remote-Integration
- Ein bedeutender Trend auf dem europäischen eCOA-Markt ist die zunehmende Integration von Mobilgeräten, Tablets und Tools zur Fernüberwachung von Patienten in klinische Studien. Dadurch wird eine nahtlose Echtzeiterfassung von patientenberichteten Ergebnissen (PROs), klinisch-ärztlichen Ergebnissen (ClinROs) und beobachterberichteten Ergebnissen (ObsROs) ermöglicht.
- Plattformen wie Medidata Rave eCOA und ERTs ClinPhone ermöglichen es Patienten beispielsweise, Beurteilungen per Fernzugriff über Smartphones oder Tablets durchzuführen, was die Einhaltung und Datenzuverlässigkeit erhöht.
- Die mobile Integration ermöglicht Funktionen wie automatische Erinnerungen, interaktive Umfrageschnittstellen und Echtzeit-Datenvalidierung und verbessert so die Genauigkeit und Vollständigkeit der Daten klinischer Studien
- Der Fernzugriff erleichtert zudem dezentrale klinische Studien, reduziert die Belastung der Patienten und erweitert die Teilnahme über geografisch verteilte Regionen hinweg. Gleichzeitig können Sponsoren den Fortschritt der Patienten nahezu in Echtzeit überwachen.
- Die nahtlose Konnektivität von eCOA-Plattformen mit elektronischen Gesundheitsakten (EHRs) und klinischen Studienmanagementsystemen (CTMS) ermöglicht eine zentrale Überwachung der Patientendaten und verbessert so die Effizienz und Compliance.
- Dieser Trend zu patientenzentrierten, technologiegestützten Studienlösungen verändert die Erwartungen an die Datenerfassung in Europa und treibt die Nachfrage nach flexiblen und benutzerfreundlichen eCOA-Plattformen voran
Marktdynamik für elektronische klinische Ergebnisbewertung (eCOA) in Europa
Treiber
Steigende Nachfrage nach präzisen klinischen Echtzeitdaten
- Der steigende Bedarf an hochwertigen, zeitnahen und patientenzentrierten Daten in klinischen Studien ist ein wichtiger Treiber für die Einführung von eCOA in ganz Europa
- So erweiterte ERT im März 2024 sein eCOA-Angebot in Europa um verbesserte mobile und Fernüberwachungsfunktionen, um die Patienteneinbindung und Datenintegrität in multinationalen Studien zu unterstützen.
- eCOA-Plattformen bieten erweiterte Funktionen wie automatisiertes Scoring, Compliance-Tracking und sofortigen Zugriff auf Versuchsdaten, die für die Einreichung von Zulassungsanträgen und evidenzbasierte Entscheidungsfindung von entscheidender Bedeutung sind.
- Die zunehmende Anzahl klinischer Studien und die zunehmende Bedeutung von patientenberichteten Ergebnissen zur Unterstützung der Wirksamkeit und Sicherheit von Behandlungen treiben die Akzeptanz weiter voran.
- Die Integration mit elektronischen Gesundheitssystemen und zentralen Dashboards vereinfacht das Datenmanagement für Sponsoren, CROs und klinische Teams und macht eCOA-Lösungen in der modernen klinischen Forschung unverzichtbar
- Steigende Investitionen in die digitale Gesundheitsinfrastruktur und der Übergang zu dezentralen und hybriden klinischen Studienmodellen treiben die Nachfrage nach eCOA-Lösungen in ganz Europa weiter voran
- Das zunehmende Bewusstsein der Gesundheitsdienstleister und Sponsoren für die Vorteile von Echtzeitanalysen und einer verbesserten Patientenbeteiligung bei klinischen Studien beschleunigt auch die Einführung von eCOA.
Einschränkung/Herausforderung
Einhaltung gesetzlicher Vorschriften und Datenschutzbedenken
- eCOA-Plattformen in Europa stehen vor Herausforderungen im Zusammenhang mit strengen regulatorischen Anforderungen, einschließlich der Einhaltung der DSGVO und regionaler Vorschriften für klinische Studien, die die Datenerfassung und -speicherung erschweren können.
- Beispielsweise erfordern Unterschiede in der nationalen Auslegung von Datenschutzgesetzen manchmal eine zusätzliche Anpassung der eCOA-Lösungen, um die vollständige Einhaltung zu gewährleisten.
- Die Gewährleistung einer sicheren Datenübertragung, Verschlüsselung und Benutzerauthentifizierung ist entscheidend, um das Vertrauen der Patienten zu erhalten und die gesetzlichen Standards einzuhalten.
- Darüber hinaus kann die unterschiedliche digitale Kompetenz von Patienten und Klinikpersonal die Akzeptanz einschränken oder zu Dateninkonsistenzen führen, insbesondere bei dezentralen Studien.
- Die Überwindung dieser Hürden durch robuste Cybersicherheitsmaßnahmen, lokalisierte Compliance-Lösungen und Schulungsinitiativen für Patienten und Standortpersonal ist für das weitere Wachstum des europäischen eCOA-Marktes von entscheidender Bedeutung.
- Hohe Implementierungs- und Wartungskosten für fortschrittliche eCOA-Plattformen können ein Hindernis darstellen, insbesondere für kleinere CROs oder akademische Forschungseinrichtungen mit begrenzten Budgets
- Der Widerstand gegen die Umstellung auf traditionelle papierbasierte Methoden kann in manchen klinischen Umgebungen die Einführung verlangsamen und erfordert Aufklärung und den Nachweis der klaren Vorteile elektronischer Systeme.
Marktumfang für elektronische klinische Ergebnisbewertung (eCOA) in Europa
Der Markt ist nach Produkt, Ansatz, Endbenutzer und Plattform segmentiert.
- Nach Produkt
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) ist produktbezogen in On-Premise-Lösungen, Cloud-Lösungen und webbasierte Lösungen unterteilt. Das Segment Cloud-basierter Lösungen dominierte den Markt mit dem größten Umsatzanteil im Jahr 2024, getrieben durch Skalierbarkeit, geringere Vorlaufkosten und Echtzeit-Zugriff für Sponsoren, CROs und klinische Prüfzentren. Cloud-basierte Plattformen ermöglichen eine nahtlose Datenerfassung von mehreren Prüfstandorten unter Einhaltung der DSGVO und anderer regionaler Vorschriften. Sie unterstützen dezentrale und hybride Prüfmodelle und ermöglichen Patienten die Fernmeldung von Ergebnissen, ohne die Prüfzentren besuchen zu müssen.
Das Segment webbasierter Lösungen wird voraussichtlich zwischen 2025 und 2032 das schnellste Wachstum verzeichnen, was auf die einfache Bereitstellung auf verschiedenen Geräten wie Desktops, Tablets und Smartphones zurückzuführen ist. Webbasierte eCOA-Plattformen bieten Echtzeit-Patientenüberwachung und -berichterstattung und verbessern so die Effizienz und Compliance von Studien. Sie werden zunehmend für dezentrale Studien bevorzugt, da sie Patienten in abgelegenen Gebieten die Teilnahme ohne Reisebeschränkungen ermöglichen. Funktionen wie automatische Erinnerungen, interaktive Umfrageschnittstellen und Echtzeitvalidierung verbessern die Datengenauigkeit und -vollständigkeit.
- Nach Ansatz
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) ist ansatzweise in die Bereiche Clinician-Reported Outcome Assessment (ClinRO), Patient-Reported Outcome Assessment (PRO), Observer-Reported Outcome Assessment (ObsRO) und Performance Outcome Assessment (PerfO) unterteilt. Das PRO-Segment dominierte den Markt mit dem größten Umsatzanteil von 47 % im Jahr 2024, was auf die zunehmende Bedeutung patientenzentrierter klinischer Studien zurückzuführen ist. PRO-Tools ermöglichen es Patienten, Symptome, Lebensqualität und Behandlungsreaktionen direkt zu melden, was die Zuverlässigkeit der Studien verbessert. Die Integration mit mobilen und Web-Plattformen verbessert die Therapietreue und die Echtzeit-Berichterstattung. Sponsoren verlassen sich zunehmend auf PRO-Daten, um Zulassungsanträge zu unterstützen und die Wirksamkeit der Behandlung aus Patientensicht nachzuweisen.
Das Segment PerfO dürfte im Prognosezeitraum die höchste Wachstumsrate aufweisen. Dies ist auf die zunehmende Verbreitung tragbarer Geräte und digitaler Leistungsbewertungstools in Studien, insbesondere in der Neurologie, Orthopädie und bei Studien zu seltenen Krankheiten, zurückzuführen. Auch die Segmente ClinRO und ObsRO verzeichnen ein stetiges Wachstum, da sie klinisch validierte und vom Pflegepersonal beobachtete Ergebnisse liefern. PerfO hingegen ist aufgrund seiner Fähigkeit, objektive Funktionsmessungen zu liefern, ein wachstumsstarkes Segment.
- Nach Endbenutzer
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) ist nach Endnutzern in kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore und akademische Einrichtungen unterteilt. Das Segment der kommerziellen Dienstleister dominierte den Markt im Jahr 2024 und nutzte seine Expertise bei der Implementierung von eCOA-Lösungen für multinationale Studien. Sie bieten End-to-End-Services, einschließlich Datenerfassung, -überwachung und -analyse, die von Pharmasponsoren hoch geschätzt werden. Krankenhäuser und Transplantationszentren setzen eCOA-Lösungen ein, um Patientenergebnisse in klinischen und praxisnahen Studien zu überwachen und so die Patientenversorgung und die Forschungsqualität zu verbessern. Forschungslabore nutzen eCOA für prüfergeführte Studien und Spezialstudien und gewährleisten so Compliance und Datenintegrität. Akademische Einrichtungen integrieren eCOA-Plattformen zunehmend in kollaborative Studien und Bildungsprogramme und unterstützen so die Ausbildung in modernen klinischen Forschungsmethoden.
Das Segment Krankenhäuser und Transplantationszentren wird im Prognosezeitraum voraussichtlich das höchste Wachstum verzeichnen. Dies ist auf die zunehmende Teilnahme an dezentralen klinischen Studien, die zunehmende Nutzung digitaler Gesundheitstools und das wachsende Bewusstsein für die Vorteile patientenzentrierter Datenerfassung zurückzuführen. Krankenhäuser nutzen diese Technologien, um die Effizienz klinischer Studien zu steigern und die Patienteneinbindung zu verbessern. Das wachsende Bewusstsein für die Vorteile patientenzentrierter Datenerfassung fördert die breitere Nutzung von eCOA-Lösungen.
- Nach Plattform
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) ist plattformbasiert in Auftragsforschungsinstitute (CROs), Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsunternehmen, Forschungs- und Hochschulen und weitere Unternehmen segmentiert. Das CRO-Segment dominierte den Markt im Jahr 2024 aufgrund seiner zentralen Rolle bei der Durchführung groß angelegter, standortübergreifender Studien und der Nutzung digitaler Lösungen für ein effizientes Studienmanagement. CROs implementieren eCOA-Plattformen, um Patientenüberwachung in Echtzeit, Compliance und zentralisierte Datenanalyse zu gewährleisten.
Pharma- und Biopharmaunternehmen werden im Prognosezeitraum voraussichtlich die höchsten Wachstumsraten verzeichnen, getrieben durch steigende Investitionen in dezentrale Studien, Technologien zur Patienteneinbindung und die Einhaltung regulatorischer Standards. Hersteller medizinischer Geräte nutzen eCOA, um Funktions- und Leistungsergebnisse in Gerätetests zu erfassen. Auch Krankenhäuser, Beratungsunternehmen und akademische Einrichtungen profitieren von integrierten eCOA-Plattformen zur Optimierung der Datenerfassung, -analyse und -berichterstattung.
Regionale Analyse des Marktes für elektronische klinische Ergebnisbewertung (eCOA) in Europa
- Deutschland dominierte den europäischen Markt für elektronische klinische Ergebnisbewertungen (eCOA) mit dem größten Umsatzanteil von 42,8 % im Jahr 2024, unterstützt durch eine starke Pharma- und Biotechnologieindustrie, eine fortschrittliche Gesundheitsinfrastruktur und die frühzeitige Einführung digitaler Testtechnologien, wobei lokale und multinationale Unternehmen aktiv eCOA-Lösungen implementierten.
- Sponsoren und CROs in Deutschland legen Wert auf die elektronische Erfassung patientenberichteter Ergebnisse, um die Datengenauigkeit zu verbessern, das Studienmanagement zu optimieren und strenge regulatorische Anforderungen, einschließlich der DSGVO und der EMA-Richtlinien, zu erfüllen.
- Die breite Akzeptanz von eCOA-Lösungen wird durch hohe Investitionen in die digitale Gesundheitsinfrastruktur, technisch versierte Fachkräfte im Gesundheitswesen und eine zunehmende Teilnahme an dezentralen und hybriden klinischen Studien zusätzlich unterstützt.
Markteinblick in die elektronische klinische Ergebnisbewertung (eCOA) in Deutschland
Der deutsche Markt für elektronische klinische Ergebnisbewertungen (eCOA) dominierte 2024 Europa, angetrieben von einer robusten Pharma- und Biotechnologiebranche, einer fortschrittlichen Gesundheitsinfrastruktur und der frühen Einführung digitaler Technologien für klinische Studien. Sponsoren und CROs priorisieren die elektronische Datenerfassung, um Genauigkeit, Compliance und Echtzeitberichte zu verbessern. Die Integration in Krankenhaus- und Kliniksysteme sowie regulatorische Unterstützung haben die Einführung beschleunigt. Die steigende Zahl dezentraler Studien und kollaborativer Forschungsinitiativen treibt das Wachstum weiter an. Deutschlands Fokus auf Innovation, patientenzentrierte Forschung und die Einhaltung strenger Datenschutzbestimmungen machen das Land zu einem Schlüsselmarkt für eCOA-Lösungen. Das Land ist auch führend bei akademischen und industriellen Partnerschaften und fördert die breitere Einführung fortschrittlicher eCOA-Plattformen.
Markteinblick in die elektronische klinische Ergebnisbewertung (eCOA) in Großbritannien
Der britische Markt für elektronische klinische Ergebnisbewertungen (eCOA) wird im Prognosezeitraum voraussichtlich mit einer bemerkenswerten durchschnittlichen jährlichen Wachstumsrate wachsen, angetrieben durch zunehmende klinische Studien und die starke Verbreitung digitaler Gesundheitstechnologien. Das gut etablierte Gesundheitssystem des Landes und das fortschrittliche regulatorische Umfeld fördern den Einsatz elektronischer Ergebnisbewertungen. Das steigende Bewusstsein für die Vorteile patientenzentrierter Studien und die Notwendigkeit der Echtzeit-Datenerfassung in dezentralen Studien treiben das Marktwachstum voran. Die Integration von eCOA in mobile Apps und Webplattformen verbessert die Compliance und das Engagement der Patienten. Großbritannien profitiert zudem von der starken Präsenz von CROs und klinischen Forschungszentren, was eine schnellere Implementierung von eCOA-Lösungen ermöglicht. Darüber hinaus unterstützen Kooperationen zwischen Pharmaunternehmen und akademischen Einrichtungen innovative Designs für klinische Studien und steigern die Nachfrage nach eCOA-Plattformen.
Markteinblick in Frankreich zur elektronischen klinischen Ergebnisbewertung (eCOA)
Der französische Markt für elektronische klinische Ergebnisbewertungen (eCOA) wächst aufgrund steigender klinischer Studienvolumina und eines zunehmenden Fokus auf patientenberichtete Ergebnisse. Die Nutzung cloud- und webbasierter eCOA-Lösungen nimmt zu, um eine sichere und konforme Datenerfassung zu gewährleisten. Der regulatorische Schwerpunkt auf elektronischer Datenerfassung und patientenzentrierten Ansätzen treibt den Markt zusätzlich an. Krankenhäuser, Forschungsinstitute und CROs in Frankreich implementieren aktiv eCOA-Plattformen, um die Datenqualität und Studieneffizienz zu verbessern. Die Integration von eCOA-Systemen in die bestehende klinische IT-Infrastruktur unterstützt nahtloses Monitoring und Reporting. Darüber hinaus wird erwartet, dass laufende staatliche Initiativen zur Förderung digitaler Gesundheitslösungen die Marktakzeptanz im Prognosezeitraum beschleunigen.
Markteinblick in Italien zur elektronischen klinischen Ergebnisbewertung (eCOA)
Der italienische Markt für elektronische klinische Ergebnisbewertungen (eCOA) wird stetig wachsen, angetrieben durch die steigende Zahl klinischer Studien und den Bedarf an patientenzentrierter Datenerfassung in Echtzeit. Italienische Gesundheitsdienstleister und Forschungseinrichtungen setzen zunehmend auf mobile und webbasierte eCOA-Lösungen, um die Studieneffizienz und die Patienten-Compliance zu verbessern. Die regulatorische Unterstützung für elektronische Ergebnisbewertungen und der Schwerpunkt auf Datenintegrität fördern die Akzeptanz. Der Markt wird zudem durch den wachsenden Trend zu dezentralen und hybriden klinischen Studien angetrieben, die die Patientenbelastung reduzieren und die Teilnahme erhöhen. Die Integration in Krankenhausinformationssysteme ermöglicht eine zentrale Überwachung und Analyse. Darüber hinaus treiben Kooperationen zwischen CROs und lokalen akademischen Einrichtungen den Einsatz fortschrittlicher eCOA-Plattformen weiter voran.
Marktanteil der elektronischen klinischen Ergebnisbewertung (eCOA) in Europa
Die europäische Branche der elektronischen klinischen Ergebnisbewertung (eCOA) wird hauptsächlich von etablierten Unternehmen angeführt, darunter:
- IQVIA (USA)
- Medidata (USA)
- Signant Health (USA)
- Clario (USA)
- ICON plc (Irland)
- Parexel International (MA) Corporation (USA)
- Kayentis (Frankreich)
- Veeva Systems (USA)
- Castor (Niederlande)
- Medable (USA)
- YPrime (USA)
- WCG Clinical (USA)
- Cloudbyz (USA)
- Climedo Health GmbH (Deutschland)
- TransPerfect (USA)
- Curebase Inc. (USA)
- EvidentIQ (Deutschland)
- ArisGlobal (USA)
- Oracle (USA)
- OmniComm Systems (USA)
Was sind die jüngsten Entwicklungen auf dem europäischen Markt für elektronische klinische Ergebnisbeurteilungen (eCOA)?
- Im Juni 2025 kündigte Medable Inc. den Start seines Partnerprogramms an, das die Startzeiten klinischer Studien beschleunigen soll. Ein wesentlicher Vorteil des Medable-Partnerprogramms ist der Zugriff auf Studio, Medables KI-basierte Lösung zum Erstellen, Speichern und Wiederverwenden von eCOA-Instrumenten. Diese Initiative soll Auftragsforschungsinstituten (CROs) mehr Kontrolle und Flexibilität bei der Skalierung ihrer Aktivitäten geben.
- Im Mai 2025 gab Clario, ein führender Anbieter digitaler Endpunktlösungen für klinische Studien, den Abschluss der Übernahme des eCOA-Geschäfts von WCG Clinical bekannt. Diese strategische Akquisition erweitert Clarios wissenschaftliche Expertise und sein Angebot im Bereich der Neurowissenschaften erheblich und festigt seine Position als wichtiger Akteur bei der Bereitstellung hochwertiger, zuverlässiger Datenerfassung und -analyse für komplexe klinische Studien.
- Im März 2025 gab das Critical Path Institute (C-Path) den erfolgreichen Abschluss seiner eCOA: Getting Better Together Initiative bekannt. Diese gemeinsame Initiative zielte darauf ab, die patientenorientierte Arzneimittelentwicklung voranzutreiben und führte zu bedeutenden, nachhaltigen Veränderungen, die allen Beteiligten im gesamten eCOA-Ökosystem zugutekommen.
- Im April 2021 gaben Veeva Systems und Parexel, ein führendes klinisches Forschungsinstitut (CRO), eine strategische Partnerschaft bekannt, um klinische Studien durch Technologie- und Prozessinnovationen zu beschleunigen. Im Rahmen dieser Zusammenarbeit standardisierte Parexel die klinischen Anwendungen von Veeva, einschließlich der elektronischen Datenmanagementlösungen, um die Studieneffizienz zu verbessern.
- Im Februar 2021 brachte ERT (jetzt Clario) seine eCOA Multimedia-Lösung auf den Markt, die die Erfassung, Verarbeitung und Analyse von Fotos und Audiodaten im Rahmen von eCOA-Beurteilungen ermöglicht. Diese Innovation ermöglicht es Patienten, Fotos von Hauterkrankungen oder Audioaufnahmen von Sprachmustern von zu Hause aus zu machen. Dies ermöglicht einen ganzheitlicheren Überblick über den Zustand eines Patienten und reduziert den Aufwand für persönliche Besuche vor Ort.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.