Europe Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
Marktgröße in Milliarden USD
CAGR :
% 
 USD
704.70 Million
USD
2,067.34 Million
2025
2033
USD
704.70 Million
USD
2,067.34 Million
2025
2033
| 2026 –2033 | |
| USD 704.70 Million | |
| USD 2,067.34 Million | |
|
|
|
|
Europäischer Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte, nach Produkt (Lösungen vor Ort, Cloud-basierte Lösungen, webbasierte Lösungen), Ansatz (Clinician Reported Outcome Assessment (ClinRO), Patient Reported Outcome Assessment (PRO), Observer Reported Outcome Assessment (ObsRO), Performance Outcome Assessment (PerfO)), Endnutzer (gewerbliche Dienstleister, Krankenhäuser und Transplantationszentren, Forschungslabore, akademische Einrichtungen), Plattform (Auftragsforschungsinstitute, Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte, Krankenhäuser und klinische Labore, Beratungsunternehmen, Forschung und Wissenschaft, Sonstige), Land (Großbritannien, Deutschland, Frankreich, Spanien, Italien, Niederlande, Schweiz, Russland, Belgien, Türkei und übriges Europa) Branchentrends und Prognose bis 2028
 Marktanalyse und Einblicke: Europäischer Markt für elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte
Marktanalyse und Einblicke: Europäischer Markt für elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte
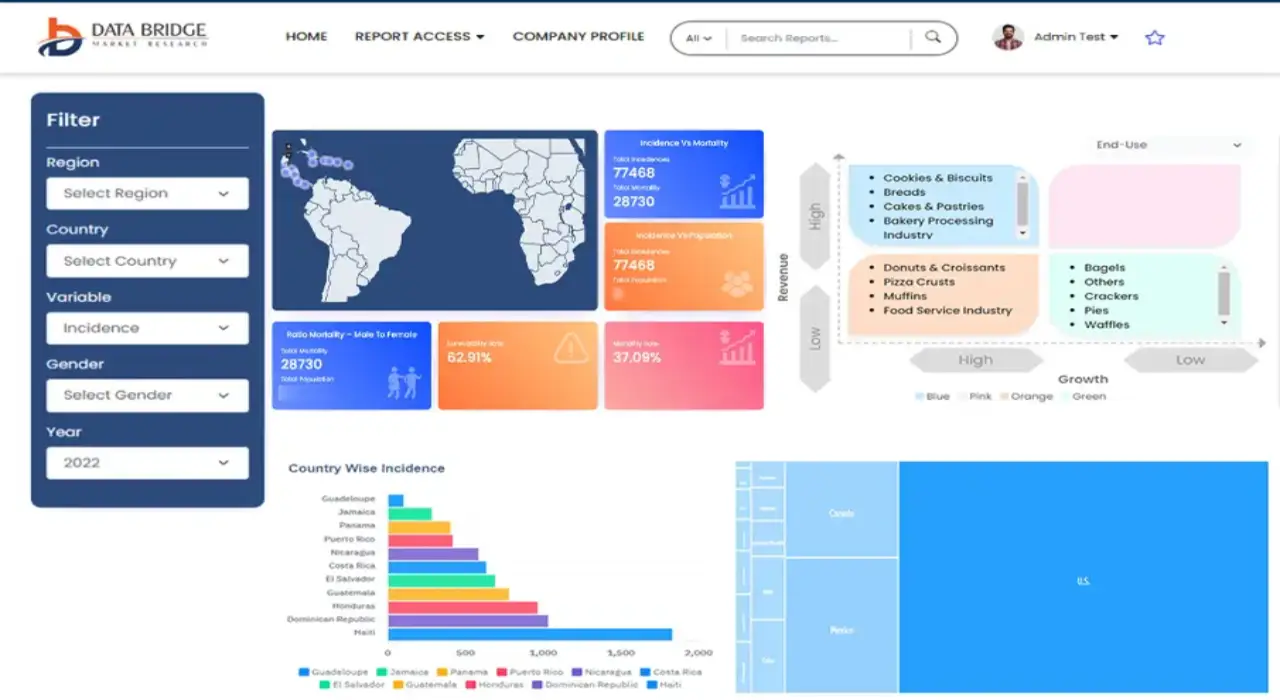
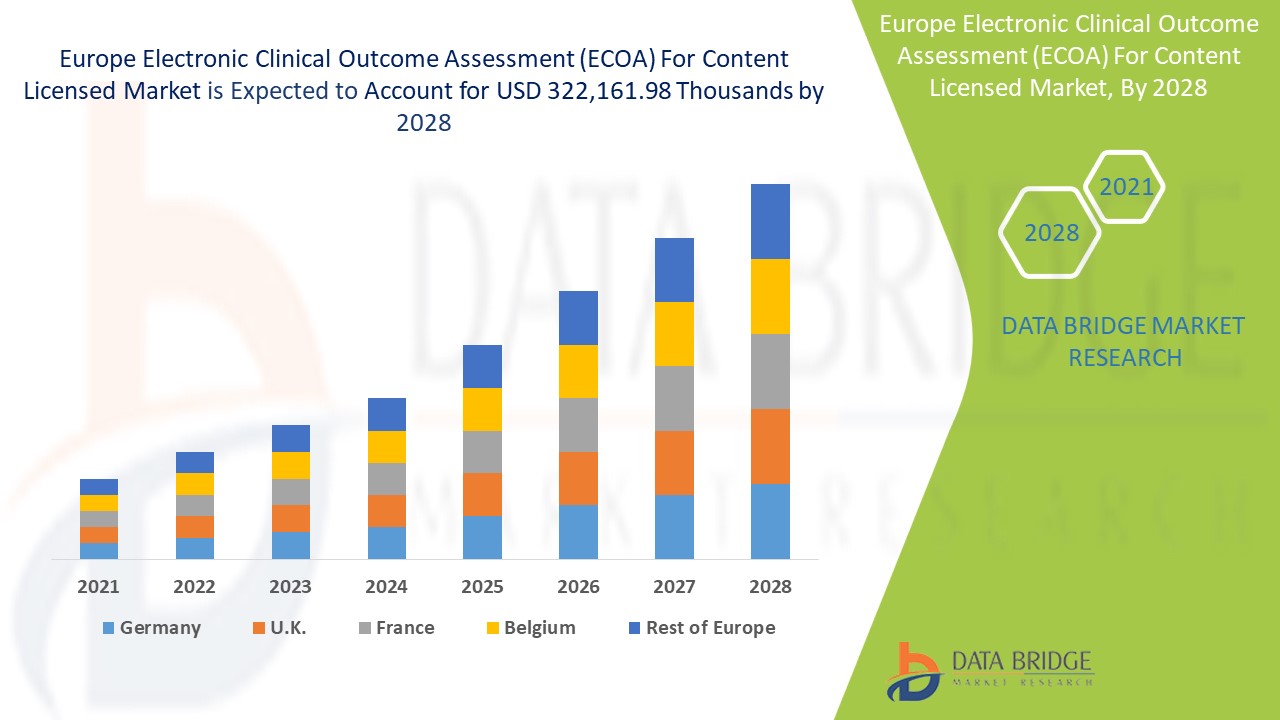
Es wird erwartet, dass der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte im Prognosezeitraum von 2021 bis 2028 an Marktwachstum gewinnt. Data Bridge Market Research analysiert, dass der Markt im Prognosezeitraum von 2021 bis 2028 mit einer durchschnittlichen jährlichen Wachstumsrate von 14,4 % wächst und bis 2028 voraussichtlich 322.161,98 Tausend USD erreichen wird. Die Einführung von eCOA wird durch den Wunsch der Pharmaindustrie vorangetrieben, enger mit den Patienten zusammenzuarbeiten, was ein wichtiger Antriebsfaktor für die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte ist.
Bei der elektronischen klinischen Ergebnisbewertung (eCOA) handelt es sich um die Methode zur elektronischen Datenerfassung bei klinischen Studien . Sie kann die Qualität der Studiendaten erheblich verbessern und gleichzeitig die gesetzlichen Anforderungen erfüllen. eCOA nutzt Technologien wie Handheld-Geräte, Tablets oder das Internet, damit Studienteilnehmer, Ärzte und Pflegekräfte Informationen zu den Ergebnissen der Gesundheitsversorgung direkt melden können.
Die wachsende Nachfrage nach eCOA aufgrund der Fähigkeit, große Datenmengen zu erfassen und gleichzeitig eine hohe Qualität sicherzustellen, beschleunigt die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte. Hohe anfängliche finanzielle Kosten im Zusammenhang mit der Implementierung und Nutzung dieser Systeme könnten die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte behindern. Steigende Innovationsniveaus und technologische Fortschritte (KI, ML, Präzisionsstudien, präzisionsgeführte Intervention, IoMT) schaffen Möglichkeiten für die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte. Der Mangel an gut ausgebildeten Fachkräften für eine genaue Dateninterpretation ist eine große Herausforderung für die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte.
Dieser Bericht über die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte enthält Einzelheiten zu Marktanteilen, neuen Entwicklungen und Produktpipeline-Analysen, Auswirkungen inländischer und lokaler Marktteilnehmer, analysiert Chancen in Bezug auf neu entstehende Umsatzbereiche, Änderungen der Marktvorschriften, Produktzulassungen, strategische Entscheidungen, Produkteinführungen, geografische Expansionen und technologische Innovationen auf dem Markt. Um die Analyse und das Szenario der elektronischen klinischen Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte zu verstehen, kontaktieren Sie uns für ein Analyst Briefing. Unser Team hilft Ihnen dabei, eine Umsatzauswirkungslösung zu entwickeln, mit der Sie Ihr gewünschtes Ziel erreichen.
 Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte Marktumfang und Marktgröße
Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte Marktumfang und Marktgröße
Der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte ist nach Produkt, Ansatz, Endbenutzer und Plattform segmentiert. Das Wachstum zwischen den Segmenten hilft Ihnen bei der Analyse von Wachstumsnischen und Strategien zur Marktbearbeitung und bestimmt Ihre wichtigsten Anwendungsbereiche und die Unterschiede in Ihren Zielmärkten.
- Auf der Grundlage des Produkts ist die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte in On-Premise-Lösungen, Cloud-basierte Lösungen und webbasierte Lösungen unterteilt. Im Jahr 2021 hält das On-Premise-Segment den größten Marktanteil an der elektronischen klinischen Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte, da On-Premise die unbefristete Lizenz mit einem festen Satz von Studien ist, die den Kunden zur Verfügung stehen.
- Basierend auf dem Ansatz wird die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte in die vom Arzt berichtete Ergebnisbewertung (ClinRO), die vom Patienten berichtete Ergebnisbewertung (PRO), die vom Beobachter berichtete Ergebnisbewertung (ObsRO) und die Leistungsergebnisbewertung (PerfO) unterteilt. Im Jahr 2021 hält das Segment der vom Arzt berichteten Ergebnisbewertung (ClinRO) den größten Marktanteil an der elektronischen klinischen Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte, da die ClinRO-Maßnahme eine klinische Beurteilung oder Interpretation der beobachtbaren Anzeichen, Verhaltensweisen oder anderen körperlichen Erscheinungen beinhaltet, von denen angenommen wird, dass sie mit einer Krankheit oder einem Zustand in Zusammenhang stehen.
- Auf der Grundlage des Endnutzers ist die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte in kommerzielle Dienstleister, Krankenhäuser und Transplantationszentren sowie Forschungslabore und akademische Einrichtungen unterteilt. Im Jahr 2021 hält das Segment Forschungslabore und akademische Einrichtungen den größten Marktanteil an der elektronischen klinischen Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte, da der Begriff „Forschungsorganisation und akademische Einrichtung“ in der klinischen und Arzneimittelentwicklungsbranche weit verbreitet ist und sich in erster Linie auf eine akademische und/oder gemeinnützige Einrichtung bezieht, die eine oder mehrere Funktionen bei der Durchführung klinischer Studien erfüllt.
- Auf der Grundlage der Plattform ist der Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte segmentiert in Auftragsforschungsinstitute , Pharma- und Biopharmaunternehmen, Hersteller medizinischer Geräte , Beratungsdienstleistungsunternehmen, Krankenhäuser und klinische Labore, Forschung und Wissenschaft und andere. Im Jahr 2021 hält das Segment der Auftragsforschungsinstitute den größten Marktanteil im Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte, da Auftragsforschungsinstitute (CROs) Dienstleistungsunternehmen sind, die die Pharma- und Biotechnologiebranche in Form von ausgelagerten pharmazeutischen Forschungsdienstleistungen (sowohl für Arzneimittel als auch für medizinische Geräte) unterstützen.
Europa: Elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte – Länderanalyse
Der europäische Markt für elektronische klinische Ergebnisbewertungen (eCOA) für lizenzierte Inhalte wird analysiert und Informationen zur Marktgröße werden nach Land, Produkt, Ansatz, Endbenutzer und Plattform bereitgestellt.
Die im europäischen Marktbericht zur elektronischen klinischen Ergebnisbewertung (eCOA) für lizenzierte Inhalte abgedeckten Länder sind das Vereinigte Königreich, Deutschland, Frankreich, Spanien, Italien, die Niederlande, die Schweiz, Russland, Belgien, die Türkei und das übrige Europa.
Der größte Marktanteil entfällt auf Großbritannien, da die Pharmaindustrie in dieser Region hohe Ausgaben für Forschung und Entwicklung tätigt und die Verbreitung von Krankheiten zunimmt, was eine Nachfrage nach hocheffizienter pharmazeutischer Forschung und Studien schafft, weshalb die elektronische klinische Ergebnisbewertung (eCOA) im Land dominiert. Deutschland dominiert mit dem zweithöchsten Marktanteil, da die Anzahl der durchgeführten klinischen Studien im Vergleich zu anderen Ländern in der Region sehr hoch ist, was den Markt in der Region ankurbelt.
Der Länderabschnitt des Berichts enthält auch Angaben zu einzelnen marktbeeinflussenden Faktoren und Änderungen der Regulierung auf dem Inlandsmarkt, die sich auf die aktuellen und zukünftigen Markttrends auswirken. Datenpunkte wie Neuverkäufe, Ersatzverkäufe, demografische Daten des Landes, Regulierungsgesetze und Import-/Exportzölle sind einige der wichtigsten Anhaltspunkte, die zur Prognose des Marktszenarios für einzelne Länder verwendet werden. Bei der Prognoseanalyse der Länderdaten werden auch die Präsenz und Verfügbarkeit europäischer Marken und ihre Herausforderungen aufgrund großer oder geringer Konkurrenz durch lokale und inländische Marken sowie die Auswirkungen der Vertriebskanäle berücksichtigt.
Steigende Zahl klinischer Studien
Die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte bietet Ihnen außerdem eine detaillierte Marktanalyse für jedes Branchenwachstum in jedem Land mit Umsatz, Komponentenverkäufen, Auswirkungen der technologischen Entwicklung auf die elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte und Änderungen in regulatorischen Szenarien mit ihrer Unterstützung für die elektronische klinische Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte. Die Daten sind für den historischen Zeitraum von 2011 bis 2019 verfügbar.
Wettbewerbsumfeld und Electronic Clinical Outcome Assessment (eCOA) für die Analyse der Marktanteile lizenzierter Inhalte
Die Wettbewerbslandschaft des Marktes für elektronische klinische Ergebnisse (eCOA) für lizenzierte Inhalte liefert Details nach Wettbewerbern. Zu den enthaltenen Details gehören Unternehmensübersicht, Unternehmensfinanzen, erzielter Umsatz, Marktpotenzial, Investitionen in Forschung und Entwicklung, neue Marktinitiativen, Präsenz in Europa, Produktionsstandorte und -anlagen, Stärken und Schwächen des Unternehmens, Produkteinführung, Produkttestpipelines, Produktzulassungen, Patente, Produktbreite und -umfang, Anwendungsdominanz, Technologie-Lebenslinienkurve. Die oben angegebenen Datenpunkte beziehen sich nur auf den Fokus der Unternehmen in Bezug auf die europäische elektronische klinische Ergebnisbewertung (eCOA) für lizenzierte Inhalte.
Die wichtigsten Akteure, die im europäischen Marktbericht zur elektronischen klinischen Ergebnisbewertung (eCOA) für lizenzierte Inhalte behandelt werden, sind Oracle, IBM Corporation, Dassault Systemes, Parexel International Corporation, ERT Clinical, ArisGlobal, Kayentis, Anju Software, Inc., Signant Health, YPrime LLC und Bioclinica sowie andere inländische Akteure. DBMR-Analysten kennen die Stärken der Konkurrenz und erstellen für jeden Wettbewerber eine separate Wettbewerbsanalyse.
Viele Produktentwicklungen werden auch von Unternehmen weltweit initiiert, die auch das Wachstum der elektronischen klinischen Ergebnisbewertung (eCOA) für den Markt für lizenzierte Inhalte beschleunigen.
Zum Beispiel,
- Im Februar 2021 hat ERT Clinical, ein weltweit führendes Daten- und Technologieunternehmen für die Erfassung klinischer Endpunktdaten, eine leistungsstarke neue Lösung namens eCOA Multimedia eingeführt, die die Erfassung, Verarbeitung und Analyse von Fotos und Audiodaten im Rahmen von eCOA-Bewertungen klinischer Studien ermöglicht. Mit dieser neuen Markteinführung hat das Unternehmen seine Produktlinie erweitert.
Partnerschaften, Joint Ventures und andere Strategien steigern den Marktanteil des Unternehmens durch größere Reichweite und Präsenz. Darüber hinaus haben Unternehmen den Vorteil, ihr Angebot für die elektronische klinische Ergebnisbewertung (eCOA) für Inhalte zu verbessern, die über einen größeren Größenbereich lizenziert sind.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.