Europäischer Markt für Materialien für klinische Studien, nach Dienstleistungen (Lagerung, Herstellung, Verpackung und Etikettierung), klinischer Phase (Phase III, Phase II, Phase IV, Phase I), therapeutischer Verwendung (Onkologie, Herz-Kreislauf-Erkrankungen, Dermatologie, Stoffwechselstörungen, Infektionskrankheiten, Atemwegserkrankungen ZNS- und psychische Störungen, Bluterkrankungen, sonstige), Endverbraucher (Auftragsforschungsinstitute, Pharma- und Biotechnologieunternehmen), Branchentrends und Prognose bis 2029.
Marktanalyse und Einblicke : Europäischer Markt für klinische Testmaterialien
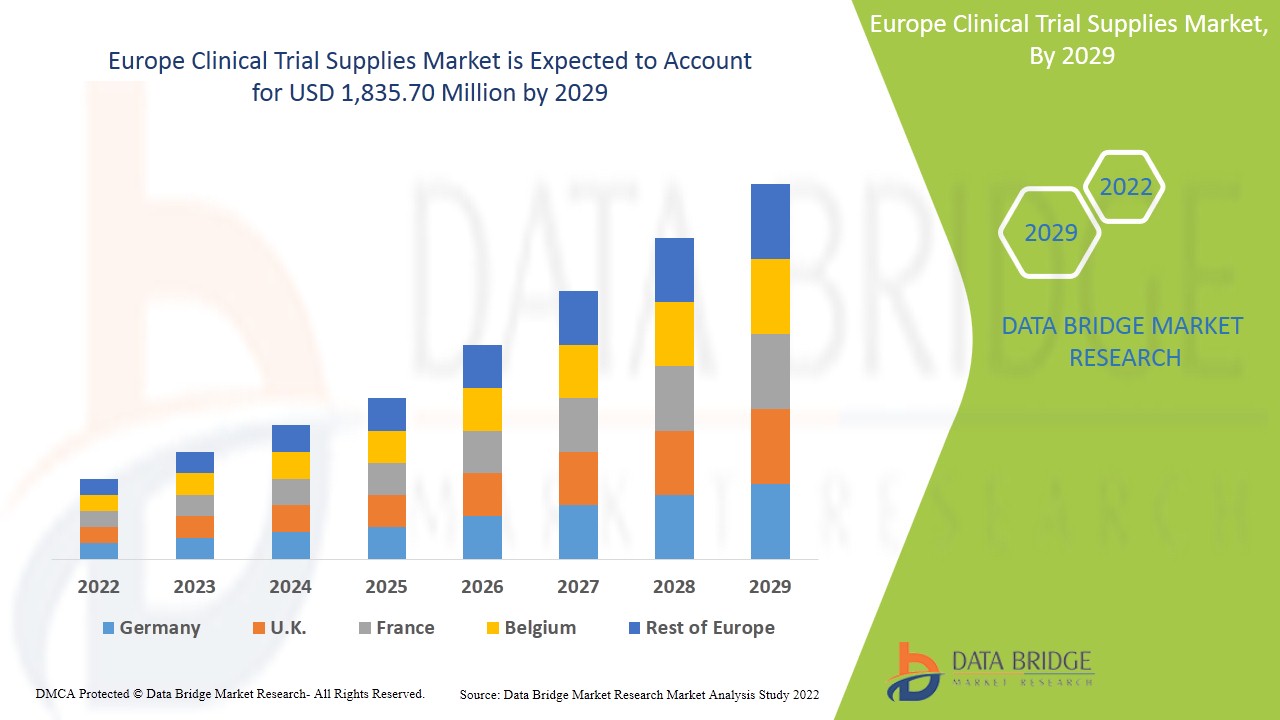
Der europäische Markt für klinische Testmaterialien wird im Prognosezeitraum 2022 bis 2029 voraussichtlich an Marktwachstum gewinnen. Data Bridge Market Research analysiert, dass der Markt im Prognosezeitraum 2022 bis 2029 mit einer durchschnittlichen jährlichen Wachstumsrate von 7,8 % wächst und bis 2029 voraussichtlich 1.835,70 Millionen USD erreichen wird. Die Hauptfaktoren für das Wachstum des Marktes für klinische Testmaterialien sind die steigende Nachfrage nach klinischen Studien weltweit, die zunehmende Häufigkeit von Krankheiten, staatliche Mittel für F&E-Investitionen und die Entwicklung neuer Behandlungsmethoden wie personalisierte Medizin, die das zukünftige Wachstum des Marktes für klinische Testmaterialien ankurbeln.
Bei einer klinischen Studie handelt es sich um eine Forschungsstudie, die bestimmt, ob eine medizinische Strategie, Behandlung oder ein Gerät für den menschlichen Gebrauch sicher, wirksam und nützlich ist. Diese Studien helfen herauszufinden, welche medizinischen Ansätze für bestimmte Krankheiten am besten geeignet sind. Eine klinische Studie liefert die besten Daten für die Entscheidungsfindung im Gesundheitswesen.
Der Zweck klinischer Studien besteht darin, strenge wissenschaftliche Standards zu verfolgen. Diese Standards schützen die Patienten und tragen zur Erzielung zuverlässiger Studienergebnisse bei.
Klinische Studien sind die letzte Phase der Arzneimittelentwicklung in einem langen und sorgfältigen Forschungsprozess, der von Wissenschaftlern oder Forschern für eine bestimmte Krankheit durchgeführt wird, sei es ein Medikament oder ein medizinisches Gerät. Der Prozess der Arzneimittelentwicklung beginnt oft in einem Labor, wo Wissenschaftler zunächst neue Ideen zur Behandlung der Krankheit entwickeln und testen.
Der europäische Marktbericht für klinische Testmaterialien enthält Einzelheiten zu Marktanteilen, neuen Entwicklungen und Produktpipeline-Analysen, Auswirkungen inländischer und lokaler Marktteilnehmer, analysiert Chancen in Bezug auf neu entstehende Umsatzbereiche, Änderungen der Marktvorschriften, Produktzulassungen , strategische Entscheidungen, Produkteinführungen, geografische Expansionen und technologische Innovationen auf dem Markt. Um die Analyse und das Marktszenario zu verstehen, kontaktieren Sie uns für ein Analyst Briefing. Unser Team hilft Ihnen dabei, eine Umsatzauswirkungslösung zu entwickeln, mit der Sie Ihr gewünschtes Ziel erreichen.
|
Berichtsmetrik |
Details |
|
Prognosezeitraum |
2022 bis 2029 |
|
Basisjahr |
2021 |
|
Historische Jahre |
2020 (Anpassbar auf 2019 – 2014) |
|
Quantitative Einheiten |
Umsatz in Millionen USD, Preise in USD |
|
Abgedeckte Segmente |
Nach Dienstleistungen (Lagerung, Herstellung, Verpackung und Etikettierung), klinischer Phase (Phase III, Phase II, Phase IV, Phase I), therapeutischer Anwendung (Onkologie, Herz-Kreislauf-Erkrankungen, Dermatologie, Stoffwechselstörungen, Infektionskrankheiten, Atemwegserkrankungen, ZNS- und psychische Störungen, Blutkrankheiten, Sonstige), nach Endverbraucher (Auftragsforschungsinstitute, Pharma- und Biotechnologieunternehmen) |
|
Abgedeckte Länder |
Deutschland, Frankreich, Großbritannien, Niederlande, Schweiz, Belgien, Russland, Italien, Spanien, Türkei, Restliches Europa in Europa |
|
Abgedeckte Marktteilnehmer |
Movianto (USA), Sharp (USA), Thermo Fisher Scientific Inc. (USA), Catalent, Inc (USA), PCI Pharma Services (USA), Almac Group (Großbritannien), PAREXEL International Corporation (USA), Bionical Ltd. (Großbritannien), Alium Medical Limited (Großbritannien), Myonex (Großbritannien), Clinigen Group plc (Großbritannien), Ancillare, LP (USA), SIRO Clinpharm (Indien), CLINICAL SUPPLIES MANAGEMENT HOLDINGS, INC. (USA), Biocair (Großbritannien) und andere. |
Marktdynamik für klinische Testmaterialien
Treiber
- Steigende Nachfrage nach klinischen Studien weltweit
Die steigende Nachfrage nach klinischen Studien liegt allein in Entwicklungsländern wie Nordamerika, Europa und Asien bei 82 %. Diese Medikamente sind erst nach klinischen Studien auf dem Markt erhältlich, daher führen alle Unternehmen klinische Studien durch, je nach Art des Medikaments oder des Geräts. Sie fungieren daher als wichtiger Treiber, der zu einer Ausweitung der Wachstumsrate des Behandlungsmarktes führen wird.
- Zunahme chronischer Erkrankungen
Die hohe Prävalenz chronischer Krankheiten aufgrund der schnell wachsenden Bevölkerung und der vielen Infektionen unter den Menschen ist weltweit zu beobachten. Diese Krankheiten spielen im Bereich klinischer Studien zur Entwicklung von Medikamenten eine wichtige Rolle. Das Medikament muss alle standardmäßigen klinischen Phasen durchlaufen, um vor dem Verzehr durch den Menschen verfügbar zu sein. Um diese chronischen Krankheiten beim Menschen behandeln zu können, muss das Medikament daher sicher sein.
- Staatliche Mittel für F&E-Investitionen
Die Instrumente, das Personal, die medizinische Betreuung im Schadensfall der Forscher, die Versicherung, der Transport, die Gebühren der Ethikkommission, die Datenverarbeitung und andere Verbrauchsmaterialien führen zu erheblichen Kosten bei klinischen Studien. Klinische Studien dienen der Bewertung von Krankheitsvorbeugung und Behandlungsideen und werden das Wachstum des Behandlungsmarktes weiter fördern.
Gelegenheiten
- Zunehmende Studien zur Entwicklung neuer Medikamente in Schwellenländern
Klinische Studien zur Wirksamkeit von Medikamenten sind der wichtigste Schlüssel für die Entwicklung von Medikamenten zur Behandlung von Krankheiten, bevor sie auf den Markt gebracht werden. Darüber hinaus müssen die neuen Medikamente vor dem Verkauf und Vertrieb Lizenzverlängerungen und internationale Standards erfüllen. Die zunehmende Verbreitung und Inzidenz von Krankheiten und die steigende Zahl der Patienten sind die Faktoren, die in den letzten Jahren zu neuen Trends bei klinischen Studien zur Entwicklung von Medikamenten in Entwicklungsländern geführt haben.
Darüber hinaus reformieren die Regierungen in den Schwellenländern (China, Brasilien, Russland, Indien und Südafrika) das öffentliche Gesundheitswesen und ermöglichen einen leichteren Zugang zu Medikamenten. Zusammengenommen bedeuten diese beiden Faktoren mehr Freiheit für Marktentwicklungen und mehr Innovation in der klinischen Forschung in den Schwellenländern.
Einschränkungen/Herausforderungen
Unerwünschte Arzneimittelwirkungen sind unerwünschte oder schädliche Wirkungen, die nach der Verabreichung eines Arzneimittels unter normalen Anwendungsbedingungen beim Menschen auftreten können. Die Arzneimittelwirkungen äußern sich im Allgemeinen in Gelbsucht, Anämie und Hautausschlägen und führen zu einer Verringerung der Anzahl weißer Blutkörperchen, Nierenschäden und Nervenverletzungen, die Seh- oder Hörbeeinträchtigungen verursachen.
Viele der Nebenwirkungen können durch körperliche Untersuchungen während der klinischen Testphase festgestellt werden. Daher ist die Meldung von Nebenwirkungen während klinischer Tests der größte Hemmfaktor für den Markt für Arzneimittel. Trotz des hohen Zeit- und Kostenaufwands für die Entwicklung von Biologika und neuen Medikamenten wird davon ausgegangen, dass die kürzeren Bearbeitungszeiten und Zulassungsquoten für Medikamente die größte Herausforderung für den Markt darstellen und das Marktwachstum behindern können.
Dieser Marktbericht für klinische Testmaterialien enthält Einzelheiten zu neuen Entwicklungen, Handelsvorschriften, Import-Export-Analysen, Produktionsanalysen, Wertschöpfungskettenoptimierungen, Marktanteilen, Auswirkungen inländischer und lokaler Marktteilnehmer, analysiert Chancen in Bezug auf neu entstehende Einnahmequellen, Änderungen der Marktvorschriften, strategische Marktwachstumsanalysen, Marktgröße, Kategoriemarktwachstum, Anwendungsnischen und -dominanz, Produktzulassungen, Produkteinführungen, geografische Expansionen und technologische Innovationen auf dem Markt. Um weitere Informationen zum Markt für klinische Testmaterialien zu erhalten, wenden Sie sich an Data Bridge Market Research, um einen Analystenbericht zu erhalten . Unser Team hilft Ihnen dabei, eine fundierte Marktentscheidung zu treffen, um Marktwachstum zu erzielen.
Jüngste Entwicklung
- Im Februar 2022 hat Thermo Fisher Scientific eine Partnerschaft mit Medidata angekündigt, um die Auswahl klinischer Forschungsstandorte zu optimieren und die Patientenaufnahme in klinische Studien zu beschleunigen. Dies verbessert die Planung und Durchführung klinischer Studien, um die klinische Studie zu beschleunigen, für die Datensätze aus 26.000 klinischen Studien und fast 8 Millionen Patienten in mehr als 140 Ländern weltweit generiert wurden.
Umfang des europäischen Marktes für klinische Testmaterialien
Der europäische Markt für klinische Testmaterialien ist nach Dienstleistungen, klinischer Phase, therapeutischer Anwendung und Endverbraucher kategorisiert. Das Wachstum in diesen Segmenten hilft Ihnen bei der Analyse schwacher Wachstumssegmente in den Branchen und bietet den Benutzern einen wertvollen Marktüberblick und Markteinblicke, um strategische Entscheidungen zur Identifizierung der wichtigsten Marktanwendungen zu treffen.
Service
- Herstellung
- Verteilung
- Lagerung
- Verpackung und Etikettierung
Auf der Grundlage der Dienstleistungen ist der europäische Markt für klinische Testmaterialien in Herstellung, Vertrieb, Lagerung sowie Verpackung und Etikettierung segmentiert.
Klinische Phase
- Phase I
- Phase II
- Phase III
- Phase IV
Auf der Grundlage der klinischen Phase ist der europäische Markt für Materialien für klinische Studien in Phase I, Phase II, Phase III und Phase IV unterteilt.
Therapeutische Anwendungen
- Onkologie
- ZNS
- Psychische Störungen
- Herz-Kreislauf-Erkrankungen
- Infektionskrankheiten
- Atemwegserkrankungen
- Blutkrankheit
- Dermatologie
- Sonstiges
Auf der Grundlage der therapeutischen Verwendung ist der europäische Markt für klinische Testmaterialien in die Bereiche Onkologie, ZNS- und psychische Störungen, Herz-Kreislauf-Erkrankungen, Infektionskrankheiten, Atemwegserkrankungen, Stoffwechselerkrankungen, Bluterkrankungen, Dermatologie und andere unterteilt.
Endbenutzer
- Auftragsforschungsinstitute
- Pharma- und Biotechnologieunternehmen
Auf der Grundlage des Endverbrauchers ist der europäische Markt für klinische Testmaterialien in Auftragsforschungsinstitute sowie Pharma- und Biotechnologieunternehmen segmentiert.
Regionale Analyse/Einblicke zum Markt für klinische Testmaterialien
Der europäische Markt für Materialien für klinische Studien ist weiter in große Länder wie Deutschland, Frankreich, Großbritannien, Italien, Spanien, Russland, Belgien, die Türkei, die Niederlande, die Schweiz und das übrige Europa unterteilt.
Großbritannien dominiert den europäischen Markt für klinische Testmaterialien in Bezug auf Marktanteil und Marktumsatz und wird seine Dominanz im Prognosezeitraum 2022–2029 weiter ausbauen. Dies ist auf die Präsenz wichtiger Akteure zurückzuführen, die in Forschung und Entwicklung investieren, um die Versorgung mit klinischen Testmaterialien zu verbessern, und auf die gut entwickelte Gesundheitsinfrastruktur in dieser Region.
Der Länderabschnitt des Berichts enthält auch Angaben zu einzelnen marktbeeinflussenden Faktoren und Änderungen der Marktvorschriften, die sich auf die aktuellen und zukünftigen Markttrends auswirken. Datenpunkte wie Neu- und Ersatzverkäufe, demografische Daten des Landes und Import- und Exportzölle sind einige der wichtigsten Anhaltspunkte, die zur Prognose des Marktszenarios für einzelne Länder verwendet werden. Darüber hinaus werden bei der Prognoseanalyse der Länderdaten die Präsenz und Verfügbarkeit globaler Marken und ihre Herausforderungen aufgrund der hohen Konkurrenz durch lokale und inländische Marken sowie die Auswirkungen der Vertriebskanäle berücksichtigt.
Wettbewerbsumfeld und Marktanteilsanalyse für klinische Testmaterialien in Europa
Die Wettbewerbslandschaft des europäischen Marktes für klinische Testmaterialien bietet Details nach Wettbewerbern. Die enthaltenen Details sind Unternehmensübersicht, Unternehmensfinanzen, erzielter Umsatz, Marktpotenzial, Investitionen in Forschung und Entwicklung, neue Marktinitiativen, Produktionsstandorte und -einrichtungen, Stärken und Schwächen des Unternehmens, Produkteinführung, Produkttestpipelines, Produktzulassungen, Patente, Produktbreite und -umfang, Anwendungsdominanz, Technologie-Lebenslinienkurve. Die oben angegebenen Datenpunkte beziehen sich nur auf den Fokus der Unternehmen in Bezug auf den Markt für klinische Testmaterialien.
Die wichtigsten Teilnehmer auf dem europäischen Markt für klinische Testmaterialien sind Movianto (USA), Sharp (USA), Thermo Fisher Scientific Inc. (USA), Catalent, Inc (USA), PCI Pharma Services (USA), Almac Group (Großbritannien), PAREXEL International Corporation (USA), Bionical Ltd. (Großbritannien), Alium Medical Limited (Großbritannien), MYODERM (Großbritannien), Clinigen Group plc (Großbritannien), Ancillare, LP (USA), SIRO Clinpharm (Indien), CLINICAL SUPPLIES MANAGEMENT HOLDINGS, INC. (USA), Biocair (Großbritannien) und andere.
Forschungsmethodik : Europäischer Markt für klinische Testmaterialien
Die Datenerfassung und die Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Die wichtigste Forschungsmethode, die das DBMR-Forschungsteam verwendet, ist die Datentriangulation, die Data Mining, Analyse der Auswirkungen von Datenvariablen auf den Markt und primäre (Branchenexperten-)Validierung umfasst. Abgesehen davon umfassen die Datenmodelle ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, einen Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Firmenmarktanteilsanalyse, Messstandards, eine globale vs. regionale und Lieferantenanteilsanalyse. Bitte fordern Sie bei weiteren Fragen einen Analystenanruf an.
SKU-
Erhalten Sie Online-Zugriff auf den Bericht zur weltweit ersten Market Intelligence Cloud
- Interaktives Datenanalyse-Dashboard
- Unternehmensanalyse-Dashboard für Chancen mit hohem Wachstumspotenzial
- Zugriff für Research-Analysten für Anpassungen und Abfragen
- Konkurrenzanalyse mit interaktivem Dashboard
- Aktuelle Nachrichten, Updates und Trendanalyse
- Nutzen Sie die Leistungsfähigkeit der Benchmark-Analyse für eine umfassende Konkurrenzverfolgung
Inhaltsverzeichnis
1 INTRODUCTION
1.1 OBJECTIVES OF THE STUDY
1.2 MARKET DEFINITION
1.3 OVERVIEW OF EUROPE CLINICAL TRIAL SUPPLIES MARKET
1.4 LIMITATIONS
1.5 MARKETS COVERED
2 MARKET SEGMENTATION
2.1 MARKETS COVERED
2.2 GEOGRAPHICAL SCOPE
2.3 YEARS CONSIDERED FOR THE STUDY
2.4 CURRENCY AND PRICING
2.5 DBMR TRIPOD DATA VALIDATION MODEL
2.6 MULTIVARIATE MODELLING
2.7 SERVICES LIFELINE CURVE
2.8 PRIMARY INTERVIEWS WITH KEY OPINION LEADERS
2.9 DBMR MARKET POSITION GRID
2.1 VENDOR SHARE ANALYSIS
2.11 SECONDARY SOURCES
2.12 ASSUMPTIONS
3 EXECUTIVE SUMMARY
4 PREMIUM INSIGHTS
4.1 PESTEL ANALYSIS
4.2 PORTERS FIVE FORCES
5 EUROPE CLINICAL TRIAL SUPPLIES MARKET: REGULATORY SCENARIO
6 MARKET OVERVIEW
6.1 DRIVERS
6.1.1 RISING DEMAND FOR CLINICAL TRIALS WORLDWIDE
6.1.2 INCREASING INCIDENCE OF CHRONIC DISEASES
6.1.3 GOVERNMENT FUNDS IN R&D INVESTMENTS
6.1.4 ADVANCEMENT OF TECHNOLOGY IN CLINICAL TRIALS SUPPLIES
6.2 RESTRAINTS
6.2.1 ADVERSE EFFECTS OF CLINICAL TRIALS
6.2.2 TRANSPORTATION ISSUE IN CLINICAL TRIAL SUPPLIES
6.2.3 HIGH COST ASSOCIATED WITH THE CLINICAL TRIALS
6.3 OPPORTUNITIES
6.3.1 INCREASING NEW DRUG DEVELOPMENT TRIALS IN EMERGING COUNTRIES
6.3.2 INCREASING DEMAND FOR INNOVATIVE SOLUTIONS IN CLINICAL TRIALS SERVICES
6.3.3 EVOLUTION IN SUPPLY CHAIN MANAGEMENT FOR CLINICAL TRIALS
6.4 CHALLENGES
6.4.1 LOWER PROCEDURE TIME OF CLINICAL TRIALS APPROVAL
6.4.2 LACK OF SKILLED PERSON TO OPERATE DEVICES DURING CLINICAL TRIALS
7 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES
7.1 OVERVIEW
7.2 STORAGE
7.3 MANUFACTURING
7.4 PACKAGING AND LABELLING
7.5 DISTRIBUTION
8 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASES
8.1 OVERVIEW
8.2 PHASE III
8.3 PHASE II
8.4 PHASE IV
8.5 PHASE I
9 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE
9.1 OVERVIEW
9.2 ONCOLOGY
9.3 CARDIOVASCULAR DISEASES
9.4 DERMATOLOGY
9.5 METABOLIC DISORDERS
9.6 INFECTIOUS DISEASES
9.7 RESPIRATORY DISEASES
9.8 CNS AND MENTAL DISORDERS
9.9 BLOOD DISORDERS
9.1 OTHERS
10 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY END USER
10.1 OVERVIEW
10.2 CONTRACT RESEARCH ORGANIZATIONS
10.3 PHARMACEUTICAL AND BIOTECHNOLOGY COMPANIES
11 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY REGION
11.1 EUROPE
11.1.1 GERMANY
11.1.2 FRANCE
11.1.3 U.K.
11.1.4 ITALY
11.1.5 SPAIN
11.1.6 NETHERLANDS
11.1.7 RUSSIA
11.1.8 BELGIUM
11.1.9 TURKEY
11.1.10 SWITZERLAND
11.1.11 REST OF EUROPE
12 EUROPE CLINICAL TRIAL SUPPLIES MARKET: COMPANY LANDSCAPE
12.1 COMPANY SHARE ANALYSIS: EUROPE
13 SWOT ANALYSIS
14 COMPANY PROFILE
14.1 THERMO FISHER SCIENTIFIC INC.
14.1.1 COMPANY SNAPSHOT
14.1.2 REVENUE ANALYSIS
14.1.3 COMPANY SHARE ANALYSIS
14.1.4 PRODUCT PORTFOLIO
14.1.5 RECENT DEVELOPMENT
14.1.5.1 PARTNERSHIP
14.2 ALMAC GROUP
14.2.1 COMPANY SNAPSHOT
14.2.2 COMPANY SHARE ANALYSIS
14.2.3 PRODUCT PORTFOLIO
14.2.4 RECENT DEVELOPMENTS
14.3 CATALENT INC.
14.3.1 COMPANY SNAPSHOT
14.3.2 REVENUE ANALYSIS
14.3.3 COMPANY SHARE ANALYSIS
14.3.4 SERVICE PORTFOLIO
14.3.5 RECENT DEVELOPMENT
14.3.5.1 SERVICE EXPANSION
14.4 CLINIGEN GROUP PLC
14.4.1 COMPANY SNAPSHOT
14.4.2 REVENUE ANALYSIS
14.4.3 COMPANY SHARE ANALYSIS
14.4.4 PRODUCT PORTFOLIO
14.4.5 RECENT DEVELOPMENT
14.4.5.1 PARTNERSHIP
14.5 MOVIANTO
14.5.1 COMPANY SNAPSHOT
14.5.2 COMPANY SHARE ANALYSIS
14.5.3 SERVICE PORTFOLIO
14.5.4 RECENT DEVELOPMENT
14.5.4.1 ACQUISITION
14.6 PCI PHARMA SERVICES
14.6.1 COMPANY SNAPSHOT
14.6.2 SERVICE PORTFOLIO
14.6.3 RECENT DEVELOPMENTS
14.7 SHARP
14.7.1 COMPANY SNAPSHOT
14.7.2 SERVICE PORTFOLIO
14.7.3 RECENT DEVELOPMENT
14.8 ALIUM MEDICAL LIMITED
14.8.1 COMPANY SNAPSHOT
14.8.2 SERVICE PORTFOLIO
14.8.3 RECENT DEVELOPMENT
14.9 ANCILLARE, LP
14.9.1 COMPANY SNAPSHOT
14.9.2 SERVICE PORTFOLIO
14.9.3 RECENT DEVELOPMENT
14.1 BIOCAIR
14.10.1 COMPANY SNAPSHOT
14.10.2 SERVICE PORTFOLIO
14.10.3 RECENT DEVELOPMENTS
14.11 BIONICAL LTD.
14.11.1 COMPANY SNAPSHOT
14.11.2 SERVICE PORTFOLIO
14.11.3 RECENT DEVELOPMENT
14.11.3.1 SERVICE LAUNCH
14.12 CLINICAL SUPPLIES MANAGEMENT HOLDINGS,INC
14.12.1 COMPANY SNAPSHOT
14.12.2 SERVICE PORTFOLIO
14.12.3 RECENT DEVELOPMENT
14.13 KLIFO
14.13.1 COMPANY SNAPSHOT
14.13.2 SERVICE PORTFOLIO
14.13.3 RECENT DEVELOPMENTS
14.13.3.1 ACQUISTION
14.14 MYONEX
14.14.1 COMPANY SNAPSHOT
14.14.2 SERVICE PORTFOLIO
14.14.3 RECENT DEVELOPMENT
14.15 PAREXEL INTERNATIONAL CORPORATION
14.15.1 COMPANY SNAPSHOT
14.15.2 SERVICE PORTFOLIO
14.15.3 RECENT DEVELOPMENT
14.15.3.1 COLLABORATION
14.16 SIRO CLINPHARM PRIVATE LIMITED
14.16.1 COMPANY SNAPSHOT
14.16.2 SERVICE PORTFOLIO
14.16.3 RECENT DEVELOPMENTS
15 QUESTIONNAIRE
16 RELATED REPORTS
Tabellenverzeichnis
TABLE 1 LOCATIONS OF REGISTERED STUDIES
TABLE 2 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 3 EUROPE STORAGE IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 4 EUROPE MANUFACTURING IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 5 EUROPE PACKAGING AND LABELLING IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 6 EUROPE DISTRIBUTION IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 7 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 8 EUROPE PHASE III IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 9 EUROPE PHASE II IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 10 EUROPE PHASE IV IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 11 EUROPE PHASE I IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 12 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 13 EUROPE ONCOLOGY IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 14 EUROPE CARDIOVASCULAR DISEASES IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 15 EUROPE DERMATOLOGY IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 16 EUROPE METABOLIC DISORDERS IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 17 EUROPE INFECTIOUS DISEASES IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 18 EUROPE RESPIRATORY DISEASES IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 19 EUROPE CNS AND MENTAL DISORDERS IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 20 EUROPE BLOOD DISORDERS IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 21 EUROPE OTHERS IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 22 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 23 EUROPE CONTRACT RESEARCH ORGANIZATIONS IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 24 EUROPE PHARMACEUTICAL AND BIOTECHNOLOGY COMPANIES IN CLINICAL TRIAL SUPPLIES MARKET, BY REGION, 2020-2029 (USD MILLION)
TABLE 25 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY COUNTRY, 2020-2029 (USD MILLION)
TABLE 26 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 27 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 28 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 29 EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 30 GERMANY CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 31 GERMANY CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 32 GERMANY CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 33 GERMANY CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 34 FRANCE CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 35 FRANCE CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 36 FRANCE CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 37 FRANCE CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 38 U.K. CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 39 U.K. CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 40 U.K. CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 41 U.K. CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 42 ITALY CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 43 ITALY CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 44 ITALY CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 45 ITALY CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 46 SPAIN CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 47 SPAIN CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 48 SPAIN CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 49 SPAIN CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 50 NETHERLANDS CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 51 NETHERLANDS CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 52 NETHERLANDS CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 53 NETHERLANDS CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 54 RUSSIA CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 55 RUSSIA CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 56 RUSSIA CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 57 RUSSIA CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 58 BELGIUM CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 59 BELGIUM CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 60 BELGIUM CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 61 BELGIUM CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 62 TURKEY CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 63 TURKEY CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 64 TURKEY CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 65 TURKEY CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 66 SWITZERLAND CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
TABLE 67 SWITZERLAND CLINICAL TRIAL SUPPLIES MARKET, BY CLINICAL PHASE, 2020-2029 (USD MILLION)
TABLE 68 SWITZERLAND CLINICAL TRIAL SUPPLIES MARKET, BY THERAPEUTIC USE, 2020-2029 (USD MILLION)
TABLE 69 SWITZERLAND CLINICAL TRIAL SUPPLIES MARKET, BY END USER, 2020-2029 (USD MILLION)
TABLE 70 REST OF EUROPE CLINICAL TRIAL SUPPLIES MARKET, BY SERVICES, 2020-2029 (USD MILLION)
Abbildungsverzeichnis
FIGURE 1 EUROPE CLINICAL TRIAL SUPLLIES MARKET: SEGMENTATION
FIGURE 2 EUROPE CLINICAL TRIAL SUPPLIES MARKET: DATA TRIANGULATION
FIGURE 3 EUROPE CLINICAL TRIAL SUPPLIES MARKET: DROC ANALYSIS
FIGURE 4 EUROPE CLINICAL TRIAL SUPPLIES MARKET: EUROPE VS REGIONAL MARKET ANALYSIS
FIGURE 5 EUROPE CLINICAL TRIAL SUPPLIES MARKET: COMPANY RESEARCH ANALYSIS
FIGURE 6 EUROPE CLINICAL TRIAL SUPLLIES MARKET: INTERVIEW DEMOGRAPHICS
FIGURE 7 EUROPE CLINICAL TRIAL SUPPLIES MARKET: DBMR MARKET POSITION GRID
FIGURE 8 EUROPE CLINICAL TRIAL SUPPLIES MARKET: DBMR VENDOR SHARE ANALYSIS
FIGURE 9 EUROPE CLINICAL TRIAL SUPPLIES MARKET: SEGMENTATION
FIGURE 10 NORTH AMERICA IS EXPECTED TO DOMINATE THE EUROPE CLINICAL TRIAL SUPPLIES MARKET IN THE FORECAST PERIOD OF 2022 TO 2029
FIGURE 11 RISING DEMAND FOR CLINICAL TRIALS WORLDWIDE AND INCREASING INCIDENCES OF DISEASES IS DRIVING THE EUROPE CLINICAL TRIAL SUPPLIES MARKET IN THE FORECAST PERIOD OF 2022 TO 2029
FIGURE 12 STORAGE SEGMENT IS EXPECTED TO ACCOUNT FOR THE LARGEST SHARE OF THE EUROPE CLINICAL TRIAL SUPPLIES MARKET IN 2022 & 2029
FIGURE 13 DRIVERS, RESTRAINTS, OPPORTUNITIES AND CHALLENGES OF EUROPE CLINICAL TRIAL SUPPLIES MARKET
FIGURE 14 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY SERVICES, 2021
FIGURE 15 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY SERVICES, 2022-2029 (USD MILLION)
FIGURE 16 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY SERVICES, CAGR (2022-2029)
FIGURE 17 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY SERVICES, LIFELINE CURVE
FIGURE 18 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY CLINICAL PHASE, 2021
FIGURE 19 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY CLINICAL PHASE, 2022-2029 (USD MILLION)
FIGURE 20 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY CLINICAL PHASE, CAGR (2022-2029)
FIGURE 21 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY CLINICAL PHASE, LIFELINE CURVE
FIGURE 22 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY THERAPEUTIC USE, 2021
FIGURE 23 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY THERAPEUTIC USE, 2022-2029 (USD MILLION)
FIGURE 24 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY THERAPEUTIC USE, CAGR (2022-2029)
FIGURE 25 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY THERAPEUTIC USE, LIFELINE CURVE
FIGURE 26 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY END USER, 2021
FIGURE 27 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY END USER, 2022-2029 (USD MILLION)
FIGURE 28 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY END USER, CAGR (2022-2029)
FIGURE 29 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY END USER, LIFELINE CURVE
FIGURE 30 EUROPE CLINICAL TRIAL SUPPLIES MARKET: SNAPSHOT (2021)
FIGURE 31 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY COUNTRY (2021)
FIGURE 32 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY COUNTRY (2022 & 2029)
FIGURE 33 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY COUNTRY (2021 & 2029)
FIGURE 34 EUROPE CLINICAL TRIAL SUPPLIES MARKET: BY SERVICES (2022-2029)
FIGURE 35 EUROPE CLINICAL TRIAL SUPPLIES MARKET: COMPANY SHARE 2021 (%)
Forschungsmethodik
Die Datenerfassung und Basisjahresanalyse werden mithilfe von Datenerfassungsmodulen mit großen Stichprobengrößen durchgeführt. Die Phase umfasst das Erhalten von Marktinformationen oder verwandten Daten aus verschiedenen Quellen und Strategien. Sie umfasst die Prüfung und Planung aller aus der Vergangenheit im Voraus erfassten Daten. Sie umfasst auch die Prüfung von Informationsinkonsistenzen, die in verschiedenen Informationsquellen auftreten. Die Marktdaten werden mithilfe von marktstatistischen und kohärenten Modellen analysiert und geschätzt. Darüber hinaus sind Marktanteilsanalyse und Schlüsseltrendanalyse die wichtigsten Erfolgsfaktoren im Marktbericht. Um mehr zu erfahren, fordern Sie bitte einen Analystenanruf an oder geben Sie Ihre Anfrage ein.
Die wichtigste Forschungsmethodik, die vom DBMR-Forschungsteam verwendet wird, ist die Datentriangulation, die Data Mining, die Analyse der Auswirkungen von Datenvariablen auf den Markt und die primäre (Branchenexperten-)Validierung umfasst. Zu den Datenmodellen gehören ein Lieferantenpositionierungsraster, eine Marktzeitlinienanalyse, ein Marktüberblick und -leitfaden, ein Firmenpositionierungsraster, eine Patentanalyse, eine Preisanalyse, eine Firmenmarktanteilsanalyse, Messstandards, eine globale versus eine regionale und Lieferantenanteilsanalyse. Um mehr über die Forschungsmethodik zu erfahren, senden Sie eine Anfrage an unsere Branchenexperten.
Anpassung möglich
Data Bridge Market Research ist ein führendes Unternehmen in der fortgeschrittenen formativen Forschung. Wir sind stolz darauf, unseren bestehenden und neuen Kunden Daten und Analysen zu bieten, die zu ihren Zielen passen. Der Bericht kann angepasst werden, um Preistrendanalysen von Zielmarken, Marktverständnis für zusätzliche Länder (fordern Sie die Länderliste an), Daten zu klinischen Studienergebnissen, Literaturübersicht, Analysen des Marktes für aufgearbeitete Produkte und Produktbasis einzuschließen. Marktanalysen von Zielkonkurrenten können von technologiebasierten Analysen bis hin zu Marktportfoliostrategien analysiert werden. Wir können so viele Wettbewerber hinzufügen, wie Sie Daten in dem von Ihnen gewünschten Format und Datenstil benötigen. Unser Analystenteam kann Ihnen auch Daten in groben Excel-Rohdateien und Pivot-Tabellen (Fact Book) bereitstellen oder Sie bei der Erstellung von Präsentationen aus den im Bericht verfügbaren Datensätzen unterstützen.