Europe Electronic Clinical Outcome Assessment Ecoa For Content Licensed Market
حجم السوق بالمليار دولار أمريكي
CAGR :
% 
 USD
704.70 Million
USD
2,067.34 Million
2025
2033
USD
704.70 Million
USD
2,067.34 Million
2025
2033
| 2026 –2033 | |
| USD 704.70 Million | |
| USD 2,067.34 Million | |
|
|
|
|
تقييم النتائج السريرية الإلكترونية (eCOA) في أوروبا لتجزئة سوق المحتوى المرخص، حسب المنتج (حلول محلية، حلول سحابية، وحلول عبر الإنترنت)، والنهج (تقييم النتائج المبلغ عنها من قبل الطبيب (ClinRO)، وتقييم النتائج المبلغ عنها من قبل المريض (PRO)، وتقييم النتائج المبلغ عنها من قبل المراقب (ObsRO)، وتقييم نتائج الأداء (PerfO))، والمستخدم النهائي (مقدمو الخدمات التجارية، والمستشفيات ومراكز زراعة الأعضاء، ومختبرات الأبحاث، والمؤسسات الأكاديمية)، والمنصة (منظمات البحوث التعاقدية، وشركات الأدوية والبيولوجيا الصيدلانية ، ومصنعي الأجهزة الطبية ، والمستشفيات والمختبرات السريرية، وشركات الخدمات الاستشارية، والبحوث والأوساط الأكاديمية، وغيرها) - اتجاهات الصناعة وتوقعاتها حتى عام 2033
حجم سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا
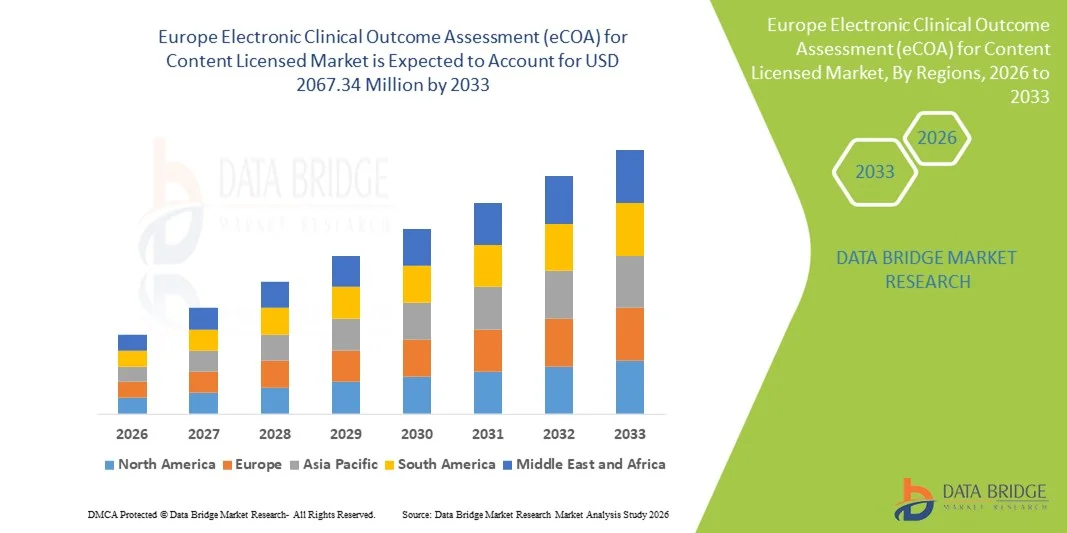
- بلغت قيمة سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا 704.7 مليون دولار أمريكي في عام 2025، ومن المتوقع أن تصل إلى 2067.34 مليون دولار أمريكي بحلول عام 2033 ، بمعدل نمو سنوي مركب قدره 14.40% خلال فترة التوقعات.
- يعود نمو السوق بشكل كبير إلى التوسع المتزايد في استخدام التقنيات الرقمية في التجارب السريرية، والتركيز المتزايد على البحوث التي تتمحور حول المريض، والحاجة إلى جمع بيانات دقيقة وفورية في مختلف المجالات العلاجية. كما أن دمج المنصات السحابية وتطبيقات الهاتف المحمول ونتائج المرضى الإلكترونية المبلغ عنها (ePRO) يُسهم في زيادة نمو سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص.
- علاوة على ذلك، يُرسّخ الطلب المتزايد على حلول التجارب السريرية المتوافقة مع اللوائح، وسهلة الاستخدام، والقابلة للتطوير، مكانة أنظمة التقييم الإلكتروني للنتائج السريرية (eCOA) كعنصر أساسي في البحوث السريرية الحديثة. وتساهم الكفاءة المُحسّنة، وتقليل الأعباء الإدارية، وتعزيز مشاركة المرضى في تسريع تبني أنظمة التقييم الإلكتروني للنتائج السريرية (eCOA) للحلول المرخصة بالمحتوى، مما يُعزز نمو السوق بشكل ملحوظ.
تحليل سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا
- يُعزى نمو سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص إلى حد كبير إلى زيادة اعتماد حلول التقييم الإلكتروني للنتائج المبلغ عنها من قبل المرضى (ePRO) وحلول eCOA في التجارب السريرية، مدفوعة بالحاجة إلى جمع البيانات بدقة وفي الوقت الفعلي وتحسين مراقبة المرضى في جميع أنحاء الرعاية الصحية والبحوث الصيدلانية.
- يؤدي الطلب المتزايد على تبسيط عمليات التجارب السريرية، والامتثال التنظيمي، وإدارة البيانات بكفاءة، إلى تسريع تبني التقييم الإلكتروني لنتائج التجارب السريرية (eCOA) لحلول المحتوى المرخص، مما يعزز نمو الصناعة بشكل كبير.
- هيمنت المملكة المتحدة على سوق التقييم الإلكتروني لنتائج التجارب السريرية (eCOA) للمحتوى المرخص، محققةً أعلى حصة من الإيرادات بلغت حوالي 38.7% في عام 2025، مدعومةً ببنية تحتية متطورة للرعاية الصحية، واعتماد واسع النطاق لتقنيات التجارب السريرية الرقمية، ودعم تنظيمي قوي لتتبع نتائج المرضى إلكترونيًا. وتشهد المملكة المتحدة نموًا ملحوظًا في تطبيقات eCOA في مختلف التجارب السريرية، مدفوعًا بالابتكارات في المنصات السحابية، وجمع البيانات عبر الأجهزة المحمولة، والتكامل مع أنظمة إدارة التجارب السريرية المركزية.
- من المتوقع أن تكون ألمانيا المنطقة الأسرع نموًا في سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص خلال الفترة المتوقعة، مع توقعات بنمو سنوي مركب قوي يتجاوز 10%. ويعزى هذا النمو إلى زيادة نشاط التجارب السريرية، وارتفاع الإنفاق على الرعاية الصحية، وتوسع نطاق الوصول إلى حلول الصحة الرقمية، وتزايد اعتماد تقنيات جمع البيانات الإلكترونية وتقنيات نتائج المرضى المبلغ عنها في المستشفيات ومراكز الأبحاث وشركات الأدوية.
- هيمن قطاع الحلول السحابية على السوق بحصة إيرادات بلغت 45.3% في عام 2025، مدفوعًا بالنشر القابل للتوسع، وسهولة الوصول عن بُعد، والتكامل مع أجهزة متعددة.
نطاق التقرير وتقييم النتائج السريرية الإلكترونية (eCOA) لتجزئة سوق المحتوى المرخص
|
صفات |
التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص: رؤى رئيسية حول السوق |
|
القطاعات التي تم تغطيتها |
|
|
الدول المشمولة |
أوروبا
|
|
اللاعبون الرئيسيون في السوق |
|
|
فرص السوق |
|
|
مجموعات بيانات القيمة المضافة |
بالإضافة إلى المعلومات المتعلقة بسيناريوهات السوق مثل قيمة السوق ومعدل النمو والتجزئة والتغطية الجغرافية واللاعبين الرئيسيين، تتضمن تقارير السوق التي أعدتها شركة Data Bridge Market Research أيضًا تحليلًا متعمقًا من قبل الخبراء، وعلم الأوبئة الخاص بالمرضى، وتحليل خطوط الإنتاج، وتحليل التسعير، والإطار التنظيمي. |
اتجاهات سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا
تزايد اعتماد حلول التجارب السريرية الرقمية
- يتمثل أحد الاتجاهات الرئيسية في السوق العالمية لأنظمة التقييم الإلكتروني للنتائج السريرية للمحتوى المرخص في زيادة اعتماد حلول التجارب السريرية الرقمية وعن بُعد، مدفوعة بالحاجة إلى جمع البيانات بكفاءة وفي الوقت الفعلي وبشكل يركز على المريض.
- فعلى سبيل المثال، في مارس 2023، قامت شركة CRF Health (التي أصبحت الآن جزءًا من Signant Health) بتوسيع منصة eCOA الخاصة بها في جميع أنحاء أوروبا لدعم التجارب السريرية اللامركزية بالكامل، مما يتيح جمع نتائج المرضى المبلغ عنها إلكترونيًا (ePRO) عبر لغات متعددة وبروتوكولات دراسة مختلفة.
- تقلل أدوات التقييم الإلكتروني للنتائج السريرية من الأخطاء، وتسرع عملية جمع البيانات، وتحسن امتثال المرضى مقارنة بالطرق الورقية التقليدية
- أدت جائحة كوفيد-19 إلى تسريع هذا الاتجاه، مما أبرز الحاجة إلى مراقبة المرضى عن بُعد وجمع البيانات دون تلامس، وهو ما يُتوقع أن يستمر بعد انتهاء الجائحة.
- تدمج شركات الأدوية ومنظمات البحوث التعاقدية (CROs) بشكل متزايد منصات التقييم الإلكتروني للنتائج السريرية (eCOA) مع تقنيات التجارب السريرية الرقمية الأخرى، مثل التقييمات الإلكترونية للنتائج السريرية للعلامات الحيوية الرقمية والأجهزة القابلة للارتداء.
تقييم النتائج السريرية الإلكترونية (eCOA) في أوروبا لديناميكيات سوق المحتوى المرخص
السائق
زيادة التركيز على التجارب السريرية التي تتمحور حول المريض
- إن التركيز المتزايد على محور المريض في التجارب السريرية يدفع إلى تبني منصات التقييم الإلكتروني للنتائج السريرية، مما يتيح جمع بيانات النتائج التي يبلغ عنها المريض في الوقت الفعلي، وتتبع الأعراض، وبيانات جودة الحياة المتعلقة بالصحة.
- فعلى سبيل المثال، أطلقت شركة باركسل إنترناشونال في يوليو 2024 حلاً جديداً لتقييم النتائج السريرية الإلكترونية (eCOA) مصمم خصيصاً لتجارب الأورام في جميع أنحاء أوروبا، مما يسمح للمرضى بالإبلاغ عن النتائج مباشرة من المنزل باستخدام واجهات الويب أو الهاتف المحمول، مما يحسن من تفاعل المرضى واستمرارهم في تلقي العلاج.
- توصي الهيئات التنظيمية، بما في ذلك وكالة الأدوية الأوروبية (EMA)، بشكل متزايد بجمع بيانات النتائج المبلغ عنها من قبل المرضى رقميًا لطلبات الموافقة على الأدوية، مما يشجع على اعتمادها على نطاق أوسع.
- تتيح القدرة على جمع بيانات عالية الجودة وموحدة وطويلة الأمد عن بُعد للجهات الراعية تحسين تصميم التجارب وتقليل العبء على المواقع.
- يوفر التكامل مع أنظمة جمع البيانات الإلكترونية (EDC) ومنصات إدارة التجارب المركزية سير عمل سلسًا لجهات رعاية التجارب السريرية ومنظمات البحث التعاقدية، مما يعزز اعتمادها بشكل أكبر
ضبط النفس/التحدي
خصوصية البيانات، والامتثال التنظيمي، وتكاليف التنفيذ
- يواجه سوق تقييم النتائج الإلكترونية تحديات تتعلق بخصوصية البيانات، والامتثال للائحة العامة لحماية البيانات، وارتفاع تكاليف التنفيذ ، مما قد يبطئ من تبنيها في جميع أنحاء العالم.
- فعلى سبيل المثال، في سبتمبر 2022، أبلغت العديد من منظمات البحث التعاقدية الأوروبية عن تأخيرات في نشر حلول التقييم الإلكتروني للنتائج السريرية في ألمانيا وفرنسا بسبب لوائح حماية البيانات الصارمة والحاجة إلى تخزين بيانات المرضى بشكل آمن.
- إن ضمان الامتثال للقوانين المحلية والإرشادات التنظيمية ومتطلبات التحقق يزيد من تعقيد تطبيق نظام تقييم النتائج الإلكترونية (eCOA)، لا سيما بالنسبة للتجارب متعددة الجنسيات.
- علاوة على ذلك، قد تكون تكاليف التكامل مع أنظمة التجارب السريرية الحالية ، بما في ذلك تدريب الموظفين والتحقق من صحة البرامج، كبيرة، مما يشكل عوائق أمام منظمات البحث التعاقدية الصغيرة والمتوسطة الحجم أو الجهات الراعية.
- يتطلب التصدي لهذه التحديات استثمارًا في الأمن السيبراني القوي، والتوافق مع الأنظمة، واستراتيجيات نشر فعالة من حيث التكلفة وقابلة للتوسع لدعم نمو السوق على المدى الطويل
نطاق سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا
يتم تقسيم السوق على أساس المنتج، والنهج، والمستخدم النهائي، والمنصة.
- المنتج الفرعي
استنادًا إلى نوع المنتج، يُقسّم سوق التقييم الإلكتروني لنتائج التجارب السريرية (eCOA) للمحتوى المرخص إلى حلول محلية، وحلول سحابية، وحلول عبر الإنترنت. وقد هيمنت الحلول السحابية على السوق بحصة إيرادات بلغت 45.3% في عام 2025، مدفوعةً بسهولة النشر على نطاق واسع، وسهولة الوصول عن بُعد، والتكامل مع أجهزة متعددة. تتيح المنصات السحابية للجهات الراعية، ومنظمات البحوث التعاقدية، والمواقع السريرية إدارة البيانات مركزيًا، وتعزيز الامتثال، وخفض تكاليف تكنولوجيا المعلومات. كما يُعزز الانتشار الواسع لهذه الحلول في التجارب السريرية متعددة المواقع، وبروتوكولات الأمان القوية، والتقارير الفورية، من هيمنتها. وتدعم مرونة نماذج الاشتراك، والتوافق مع اللوائح التنظيمية، والتكامل مع أنظمة جمع البيانات الإلكترونية (EDC) وأنظمة الإبلاغ الإلكتروني عن نتائج التجارب السريرية (ePRO) النمو بشكل أكبر. وتُفضل شركات الأدوية الكبرى الحلول السحابية للتجارب العالمية. وقد ساهمت جائحة كوفيد-19 في تسريع تبني هذه الحلول نظرًا لاحتياجات المراقبة عن بُعد. كما يُعزز تحسين وقت التشغيل ودعم الموردين الحصة السوقية. ويضمن التحقق الموحد عبر المواقع الموثوقية. وتُساهم كفاءة التكلفة وتحسين سير العمل في تعزيز الريادة. تجذب ميزات التحليلات المحسّنة ولوحة التحكم المستخدمين النهائيين. كما يُحسّن التكامل مع تطبيقات الهاتف المحمول التزام المرضى بالعلاج. وبشكل عام، تُسهم هذه العوامل في الحفاظ على الريادة.
من المتوقع أن يشهد قطاع حلول الأنظمة المحلية أسرع معدل نمو سنوي مركب بنسبة 14.8% خلال الفترة من 2026 إلى 2033، مدفوعًا بالمؤسسات التي تتطلب تحكمًا داخليًا في البيانات وتخصيصها. وتتبنى المستشفيات ومنظمات البحوث التعاقدية وشركات التكنولوجيا الحيوية التي تطبق حوكمة صارمة للبيانات أنظمة الأنظمة المحلية. ويعزز التكامل مع البنية التحتية لتكنولوجيا المعلومات القديمة من جاذبية هذه الأنظمة. كما أن متطلبات الأمان العالية للبيانات السريرية الحساسة تشجع على تبنيها. ويساهم الطلب المتزايد في المناطق ذات اللوائح الصارمة لحماية خصوصية البيانات في دعم النمو. وتُحسّن التقارير والتحليلات المتقدمة من كفاءة العمليات. وتُسرّع عمليات النشر على مستوى المؤسسات من استخدام هذه الأنظمة. ويجذب توفر الوحدات القابلة للتخصيص كبار المستثمرين. ويضمن دعم تكنولوجيا المعلومات الداخلي صيانة فعّالة. وتُكمّل الحاجة المتزايدة لخيارات النشر الهجينة عملية التوسع. كما يُعزز استثمار شركات الأدوية في تجارب الطب الشخصي من تبني هذه الأنظمة. ويُعزز التدريب والدعم الفني من عملية التنفيذ. ويضمن التوافق مع اللوائح التنظيمية لهيئة الغذاء والدواء الأمريكية ووكالة الأدوية الأوروبية تسريع عملية التبني.
- عن طريق الاقتراب
استنادًا إلى المنهجية، يُقسّم السوق إلى أربعة قطاعات رئيسية: ClinRO، وPRO، وObsRO، وPerfO. وقد هيمن قطاع نتائج المرضى المبلغ عنها (PRO) بحصة إيرادات بلغت 42.1% في عام 2025، مدفوعًا بتزايد استخدامه في طلبات الترخيص، والتجارب السريرية التي تركز على المريض، ودراسات الأدلة الواقعية. يتيح PRO قياسًا مباشرًا لحالة المريض الصحية، ورضاه عن العلاج، ومؤشرات جودة الحياة. ويعزز التكامل مع تطبيقات الهاتف المحمول والمنصات السحابية من اعتماده. كما يدعم الدعم القوي من إدارة الغذاء والدواء الأمريكية (FDA) ووكالة الأدوية الأوروبية (EMA) الطلب عليه. ويُسهم الانتشار الواسع للأمراض المزمنة وتجارب الأورام في زيادة استخدامه. وتعتمد نقاط النهاية السريرية بشكل متزايد على بيانات PRO. ويساهم دعم اللغات المتعددة في توسيع نطاق استخدامه عالميًا. وتُحسّن التذكيرات الآلية من الامتثال. ويزيد جمع البيانات المتكرر من حجمها وفائدتها. ويُعزز التكامل مع أنظمة تقييم النتائج السريرية الإلكترونية (eCOA) والمذكرات الإلكترونية والأجهزة القابلة للارتداء سير العمل. ويُسرّع استثمار شركات الأدوية في نقاط النهاية القائمة على PRO من اعتماده. وتدعم قابلية التوسع عبر المواقع والتجارب هيمنته. وتُمكّن التحليلات المتقدمة من تقسيم المرضى وتتبع نتائجهم.
من المتوقع أن يشهد قطاع ObsRO أسرع نمو سنوي مركب بنسبة 15.6% خلال الفترة من 2026 إلى 2033، وذلك نتيجةً لتزايد اعتماده في مجالات الأمراض النادرة، وطب الأطفال، والنتائج التي يُبلغ عنها مقدمو الرعاية. تُعزز البيانات التي يُبلغ عنها المراقبون دقة القياس لدى الفئات السكانية غير القادرة على الإبلاغ الذاتي. ويُحفز نمو الدراسات في طب الأطفال وكبار السن الطلب على هذا القطاع. كما يُسهل التكامل مع منصات المراقبة عن بُعد عملية اعتماده. ويدعم استثمار شركات الأدوية والتكنولوجيا الحيوية في تجارب الأمراض النادرة التوسع في هذا المجال. ويُحسّن توحيد المعايير في مواقع متعددة موثوقية البيانات. وتُسرّع حلول الحوسبة السحابية والويب من عملية التبني. كما يُعزز الإبلاغ عبر الأجهزة المحمولة من قِبل المراقبين الامتثال للمعايير. وتتبنى الأسواق الناشئة بشكل متزايد مناهج ObsRO. ويُعزز القبول التنظيمي لنقاط نهاية ObsRO النمو. ويُشجع التدريب ودعم المواقع على التنفيذ. وتُقلل التطورات التكنولوجية من أخطاء الإدخال اليدوي. وتُساهم القيمة العالية للتجارب متعددة الأطراف في تسريع النمو.
- بواسطة المستخدم النهائي
استنادًا إلى المستخدم النهائي، يُقسّم السوق إلى مزودي الخدمات التجارية، والمستشفيات ومراكز زراعة الأعضاء، ومختبرات الأبحاث، والمؤسسات الأكاديمية. وقد هيمن قطاع المستشفيات ومراكز زراعة الأعضاء بحصة إيرادات بلغت 47.2% في عام 2025، وذلك بفضل النشاط المكثف للتجارب السريرية، وكثرة أعداد المرضى، والحاجة إلى أنظمة متكاملة لتقييم النتائج. تُطبّق المستشفيات نظام التقييم الإلكتروني للنتائج السريرية (eCOA) لإدارة الأمراض المزمنة، وتجارب الأورام، وتتبع نتائج العمليات الجراحية. ويُعزز الإقبال الكبير على هذا النظام في التجارب متعددة المراكز من استخدامه. كما يُحسّن التكامل مع أنظمة السجلات الصحية الإلكترونية (EHR) والسجلات الطبية الإلكترونية (EMR) من كفاءة سير العمل. وتُساهم المتطلبات التنظيمية لجمع بيانات النتائج السريرية في زيادة الطلب. وتضمن برامج التدريب والدعم واسعة النطاق اعتماد النظام. ويُعزز أمن البيانات والامتثال لمعايير HIPAA/GDPR الثقة. ويُحسّن دعم الأجهزة المتعددة من تفاعل المرضى والأطباء. وتدعم التحليلات الفورية القرارات التشغيلية. وتزيد الشراكات مع منظمات البحث التعاقدية (CROs) من انتشار النظام. وتُوسّع مراقبة المرضى عن بُعد نطاق الوصول. ويُعزز الاستثمار في الأبحاث السريرية القائمة على المستشفيات الريادة. وتُحافظ برامج التحسين المستمر على الهيمنة.
من المتوقع أن يشهد قطاع مزودي الخدمات التجارية أسرع نمو سنوي مركب بنسبة 16.3% خلال الفترة من 2026 إلى 2033، مدفوعًا باتجاهات الاستعانة بمصادر خارجية في التجارب السريرية والحاجة المتزايدة لإدارة متخصصة لنتائج التقييم الإلكتروني للنتائج السريرية (eCOA). تقدم منظمات البحوث التعاقدية (CROs) وموردي الخدمات السريرية حلولًا سحابية وعبر الإنترنت للتجارب متعددة المواقع. ويساهم تزايد البحوث التعاقدية في مجالات الأورام، وعلم الأعصاب، والأمراض النادرة في تعزيز هذا النمو. كما تجذب مرونة تقديم الخدمات عملاء من شركات الأدوية المتوسطة والصغيرة. وتُحسّن التقارير والتحليلات المتقدمة كفاءة التجارب. ويدعم التوسع في الأسواق الناشئة عملية التبني. ويُقلل التدريب والدعم عن بُعد من عوائق التنفيذ. ويضمن التكامل مع أنظمة جمع البيانات الإلكترونية (EDC) وأنظمة نتائج تقييم المرضى (PRO) سير عمل سلس. ويظل أمن البيانات والامتثال التنظيمي من العوامل الرئيسية المحركة للنمو. وتُسرّع قابلية التوسع للتجارب العالمية من وتيرة الاستخدام. وتُساهم الشراكات الاستراتيجية مع الجهات الراعية في توسيع نطاق الوصول إلى السوق. ويُحفز الابتكار في تكامل الأجهزة المحمولة والقابلة للارتداء التبني السريع.
- حسب المنصة
استنادًا إلى المنصة، يُقسّم السوق إلى منظمات البحوث التعاقدية، وشركات الأدوية والبيولوجيا الصيدلانية، ومصنّعي الأجهزة الطبية، والمستشفيات والمختبرات السريرية، وشركات الخدمات الاستشارية، ومراكز البحوث والأوساط الأكاديمية، وغيرها. وقد هيمنت شركات الأدوية والبيولوجيا الصيدلانية على السوق بحصة إيرادات بلغت 44.7% في عام 2025، وذلك بفضل برامج التطوير السريري واسعة النطاق، واعتماد تجارب الطب الدقيق، والاعتماد على بيانات النتائج الإلكترونية في تقديم الطلبات التنظيمية. تستثمر شركات الأدوية في منصات eCOA المتكاملة لدراسات الأورام، وأمراض القلب، والأمراض المزمنة. ويدعم حجم التجارب الكبير والعمليات العالمية هذه الهيمنة. كما يُسهم التكامل مع أنظمة جمع البيانات الإلكترونية (EDC) وتقارير النتائج المُبلغ عنها من قِبل المرضى (PRO) والأجهزة القابلة للارتداء في تبسيط سير العمل. ويُحفّز الامتثال التنظيمي على اعتماد هذه المنصات. وتُعزز الإدارة المركزية للبيانات كفاءة التجارب. وتُعزز شراكات الموردين طويلة الأجل الريادة. ويدعم النشر متعدد الأجهزة والمواقع الاستخدام. وتُحسّن الحلول السحابية إمكانية الوصول. ويزيد الاستثمار في التشخيص المصاحب من استخدام المنصة. ويُعزز إعداد التقارير في الوقت الفعلي عملية اتخاذ القرارات. تساهم التحليلات المتقدمة في تسريع برامج تطوير الأدوية.
من المتوقع أن يشهد قطاع منظمات البحث التعاقدية (CROs) أسرع نمو سنوي مركب بنسبة 15.8% خلال الفترة من 2026 إلى 2033، مدفوعًا بالاستعانة بمصادر خارجية لإجراء التجارب السريرية، وزيادة تعقيد التجارب، والطلب المتزايد على إدارة خدمات التقييم الإلكتروني للنتائج السريرية (eCOA) المتكاملة. توفر منظمات البحث التعاقدية منصات eCOA قابلة للتطوير وقائمة على الحوسبة السحابية للدراسات متعددة الجنسيات. ويساهم التبني السريع لهذه المنصات في الأسواق الناشئة في تسريع النمو. كما يُحسّن التكامل مع أنظمة الجهات الراعية الكفاءة التشغيلية. وتُعزز التحليلات المتقدمة ولوحات المعلومات رؤى التجارب. وتجذب نماذج النشر المرنة عملاء شركات الأدوية المتوسطة والصغيرة. ويُسهّل التدريب والدعم الفني عملية التبني. ويعزز التوافق مع اللوائح التنظيمية العالمية الثقة. ويُحفز تبني هذه المنصات في مجالات علاجية متعددة التوسع. كما تُحسّن التقارير عبر الأجهزة المحمولة والتقارير عن بُعد الامتثال. وتُعزز الشراكات الاستراتيجية مع المستشفيات والمؤسسات الأكاديمية الحضور. وبشكل عام، تُسهم هذه العوامل في تحقيق نمو قوي.
تحليل إقليمي لسوق المحتوى المرخص باستخدام التقييم الإلكتروني للنتائج السريرية (eCOA) في أوروبا
- من المتوقع أن يشهد سوق التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص في أوروبا نموًا كبيرًا بمعدل نمو سنوي مركب خلال فترة التوقعات.
- مدفوعةً بالاعتماد المتزايد لحلول التجارب السريرية الرقمية، والدعم التنظيمي الصارم، والطلب المتزايد على تتبع نتائج المرضى بكفاءة
- يُعزى النمو إلى دمج المنصات السحابية، وجمع البيانات عبر الأجهزة المحمولة، والنتائج الإلكترونية التي يُبلغ عنها المرضى، إلى جانب تركيز المنطقة على تعزيز البنية التحتية للرعاية الصحية والتحول الرقمي في البحوث السريرية.
تقييم النتائج السريرية الإلكترونية (eCOA) في المملكة المتحدة لرؤى سوق المحتوى المرخص
هيمنت المملكة المتحدة على سوق التقييم الإلكتروني لنتائج التجارب السريرية (eCOA) للمحتوى المرخص، محققةً أعلى حصة من الإيرادات بلغت حوالي 38.7% في عام 2025، مدعومةً ببنية تحتية متطورة للرعاية الصحية، واعتماد واسع النطاق لتقنيات التجارب السريرية الرقمية، ودعم تنظيمي قوي لتتبع نتائج المرضى إلكترونيًا. ويُعزى هذا النمو الكبير إلى الابتكارات في المنصات السحابية، وجمع البيانات عبر الأجهزة المحمولة، والتكامل السلس مع أنظمة إدارة التجارب السريرية المركزية، مما يُتيح قياس نتائج المرضى بكفاءة ودقة أكبر.
تقييم النتائج السريرية الإلكترونية (eCOA) في ألمانيا لرؤى سوق المحتوى المرخص
من المتوقع أن تشهد ألمانيا أسرع نمو في سوق تقييم النتائج السريرية الإلكترونية (eCOA) للمحتوى المرخص خلال الفترة المتوقعة، مع توقعات بنمو سنوي مركب قوي يتجاوز 10%. ويعزى هذا النمو إلى ازدياد نشاط التجارب السريرية، وارتفاع الإنفاق على الرعاية الصحية، وتوسع نطاق الوصول إلى حلول الصحة الرقمية، وتزايد اعتماد تقنيات جمع البيانات الإلكترونية ونتائج المرضى المبلغ عنها في المستشفيات ومراكز الأبحاث وشركات الأدوية. إضافةً إلى ذلك، يُسهم تركيز ألمانيا على الابتكار التكنولوجي والبنية التحتية الرقمية للرعاية الصحية في دعم التوسع السريع للسوق.
حصة السوق الأوروبية لتقييم النتائج السريرية الإلكترونية (eCOA) للمحتوى المرخص
تتولى شركات راسخة قيادة صناعة التقييم الإلكتروني للنتائج السريرية (eCOA) للمحتوى المرخص، بما في ذلك:
• شركة Medidata Solutions (الولايات المتحدة)
• شركة CRF Health (المملكة المتحدة)
• شركة Signant Health (الولايات المتحدة)
• شركة Clinion (الولايات المتحدة)
• شركة Celegence (الولايات المتحدة)
• شركة Icon plc (أيرلندا ) •
شركة PPD (الولايات المتحدة)
• شركة Veeva Systems (الولايات المتحدة)
• شركة Oracle Health Sciences (الولايات المتحدة)
• شركة Synteract (الولايات المتحدة)
• شركة Bioclinica (الولايات المتحدة)
• شركة Complion (
الولايات المتحدة) • شركة Curebase
(الولايات المتحدة) • شركة ClinOne (الولايات المتحدة)
• شركة CRF Bracket (الولايات المتحدة)
• شركة Datatrak International (الولايات المتحدة)
• شركة Electronic Data Capture (الولايات المتحدة)
• شركة PAREXEL International (الولايات المتحدة)
• شركة Health Solutions International (المملكة المتحدة)
آخر التطورات في أوروبا: التقييم الإلكتروني للنتائج السريرية (eCOA) لسوق المحتوى المرخص
- في يونيو 2023، أطلقت شركة ICON plc منصة ICON الرقمية، وهي حل متكامل يشمل تطبيقات الهاتف المحمول للمرضى، والموافقة الإلكترونية، وتقييم النتائج السريرية الإلكتروني، والتقاط البيانات المباشر للخدمات المنزلية، وإدارة تكنولوجيا الصحة الرقمية لتبسيط مشاركة المرضى وجمع البيانات في جميع التجارب السريرية، مما يمثل توسعًا كبيرًا في قدرات تقييم النتائج السريرية الإلكتروني لتشمل عمليات التجارب السريرية الرقمية الأوسع نطاقًا
- في يوليو 2023، استحوذت شركة Signant Health على شركة DSG، مما وسّع محفظة تقنيات التجارب السريرية الإلكترونية والهجينة لتشمل قدرات محسّنة في جمع البيانات الإلكترونية/جمع البيانات الرقمية، وعزز وجودها في بيئات البحوث السريرية المعقدة، لا سيما في أوروبا.
- في نوفمبر 2023، وسّعت شركة Clinical Ink حلولها الخاصة بإشراك المرضى من خلال دمج أداة SPUR التشخيصية السلوكية مع مجموعة eCOA والمؤشرات الحيوية الرقمية، مما يوفر رؤى أعمق حول سلوك المرضى ويحسّن التقييم الشامل للنتائج السريرية عبر التجارب.
- في نوفمبر 2024، أكملت شركة uMotif عملية الاستحواذ على شركة ClinOne، حيث جمعت بين إمكانيات eCOA/ePRO وأدوات إدارة إنتاجية المواقع والموافقة لإنشاء منصة موحدة تقلل من النفقات الإدارية وتعزز كفاءة المشاركة في التجارب السريرية
- في فبراير 2025، أعلنت شركة YPrime عن إطلاق ميزة نموذج تغيير البيانات الآلي (DCF) كجزء من منصة eCOA 7.x الخاصة بها، مما يوفر إدارة مبسطة وفعالة للبيانات السريرية ويحسن الدقة في سير عمل بيانات التجارب.
- في عام 2025، تم اختيار شركة Medable Inc. كشركة رائدة في تقييم مصفوفة PEAK لمنتجات eCOA لعلوم الحياة التابع لمجموعة Everest، وذلك تقديراً لابتكاراتها في مجال الذكاء الاصطناعي، والتحليلات في الوقت الفعلي، وجمع البيانات متعددة الوسائط التي تعمل على تبسيط تقييمات النتائج السريرية وتعزيز مشاركة المرضى.
SKU-
احصل على إمكانية الوصول عبر الإنترنت إلى التقرير الخاص بأول سحابة استخبارات سوقية في العالم
- لوحة معلومات تحليل البيانات التفاعلية
- لوحة معلومات تحليل الشركة للفرص ذات إمكانات النمو العالية
- إمكانية وصول محلل الأبحاث للتخصيص والاستعلامات
- تحليل المنافسين باستخدام لوحة معلومات تفاعلية
- آخر الأخبار والتحديثات وتحليل الاتجاهات
- استغل قوة تحليل المعايير لتتبع المنافسين بشكل شامل
منهجية البحث
يتم جمع البيانات وتحليل سنة الأساس باستخدام وحدات جمع البيانات ذات أحجام العينات الكبيرة. تتضمن المرحلة الحصول على معلومات السوق أو البيانات ذات الصلة من خلال مصادر واستراتيجيات مختلفة. تتضمن فحص وتخطيط جميع البيانات المكتسبة من الماضي مسبقًا. كما تتضمن فحص التناقضات في المعلومات التي شوهدت عبر مصادر المعلومات المختلفة. يتم تحليل بيانات السوق وتقديرها باستخدام نماذج إحصائية ومتماسكة للسوق. كما أن تحليل حصة السوق وتحليل الاتجاهات الرئيسية هي عوامل النجاح الرئيسية في تقرير السوق. لمعرفة المزيد، يرجى طلب مكالمة محلل أو إرسال استفسارك.
منهجية البحث الرئيسية التي يستخدمها فريق بحث DBMR هي التثليث البيانات والتي تتضمن استخراج البيانات وتحليل تأثير متغيرات البيانات على السوق والتحقق الأولي (من قبل خبراء الصناعة). تتضمن نماذج البيانات شبكة تحديد موقف البائعين، وتحليل خط زمني للسوق، ونظرة عامة على السوق ودليل، وشبكة تحديد موقف الشركة، وتحليل براءات الاختراع، وتحليل التسعير، وتحليل حصة الشركة في السوق، ومعايير القياس، وتحليل حصة البائعين على المستوى العالمي مقابل الإقليمي. لمعرفة المزيد عن منهجية البحث، أرسل استفسارًا للتحدث إلى خبراء الصناعة لدينا.
التخصيص متاح
تعد Data Bridge Market Research رائدة في مجال البحوث التكوينية المتقدمة. ونحن نفخر بخدمة عملائنا الحاليين والجدد بالبيانات والتحليلات التي تتطابق مع هدفهم. ويمكن تخصيص التقرير ليشمل تحليل اتجاه الأسعار للعلامات التجارية المستهدفة وفهم السوق في بلدان إضافية (اطلب قائمة البلدان)، وبيانات نتائج التجارب السريرية، ومراجعة الأدبيات، وتحليل السوق المجدد وقاعدة المنتج. ويمكن تحليل تحليل السوق للمنافسين المستهدفين من التحليل القائم على التكنولوجيا إلى استراتيجيات محفظة السوق. ويمكننا إضافة عدد كبير من المنافسين الذين تحتاج إلى بيانات عنهم بالتنسيق وأسلوب البيانات الذي تبحث عنه. ويمكن لفريق المحللين لدينا أيضًا تزويدك بالبيانات في ملفات Excel الخام أو جداول البيانات المحورية (كتاب الحقائق) أو مساعدتك في إنشاء عروض تقديمية من مجموعات البيانات المتوفرة في التقرير.